Noviembre 22 de 2017
Hola Paula y Juan Jose.
Los espero este miércoles de 2:00 a 3:00 p.m con todas las actividades de clase y extra clase al día.
Prepárate bien para las evaluaciones de los respectivos temas.
Animo.
Hola queridos estudiantes. Nuestro año escolar 2017 llego a su fin.
Gracias por todos sus aportes, esfuerzos, dedicación.....
Pronto darán fin a la etapa de la secundaria, por ello deben seguir creciendo como personas responsables y dedicados más a su estudio.
Gracias padres de familia por todo el apoyo brindado y en especial por el amor y acompañamiento incondicional con sus hijos.
ACTIVIDADES DE CLASE:
Criterio
|
Autoevaluación
|
Coevaluación
|
Heteroevaluación
| |
1
|
Cumplo con la presentación oportuna de tareas y trabajos.
| |||
2
|
Presento buena disposición en clase, soy atento y participativo.
| |||
3
|
Mantengo buena disciplina durante la clase.
| |||
4
|
Acato los normas de presentación personal establecidas por la Institución.
| |||
5
|
Soy ordenado y aseado con mi entorno.
|
Total:
Relaciono las notas a la fecha, faltando por registrar en planilla la auto evaluación, la coevaluación y la heteroevaluación son:
AMADO MEJIA ANA VALENTINA
|
4,86153846
|
BARRERO OLIVEIRA MARIA
VICTORIA
|
4,83076923
|
CARTAGENA ROJAS JHON
ALEXANDER
|
4,86923077
|
MORALES FAYAD ANA ZHARIHE
|
3,68461538
|
MATIZ RODRIGUEZ NICOLE
DAYANA
|
3,06153846
|
MEDINA GONZALEZ AURA LUCIA
|
4,79230769
|
NAVARRO RAMIREZ JUAN JOSE
|
2,13846154
|
REYES ANA SOFIA
|
4,81538462
|
RODRIGUEZ ROY SANTIAGO
|
3,63846154
|
TELLO FONSECA MARIA
ALEJANDRA
|
3,6
|
VERA SANTAMIRA PAULA ANDREA
|
2,76923077
|
SI EN LA NOTA FINAL QUE SE DARÁ EN LA CLASE, QUEDA ALGÚN ESTUDIANTE CON DESEMPEÑO BAJO, ESTE SE CITARÁ PARA EL 22 DE NOVIEMBRE A LAS 2:00 P.M, CON LAS ACTIVIDADES DE CLASE Y EXTRA CLASE AL DÍA, CON LAS EVALUACIONES CORREGIDAS, ARGUMENTADAS Y ESTUDIADAS, PARA REALIZAR LA RESPECTIVA NIVELACIÓN.

Noviembre 09 de 2017
ACTIVIDADES DE CLASE:
Evaluación final de competencia. Favor estudiar los temas vistos.
Noviembre 02 de 2017
Noviembre 02 de 2017
ACTIVIDADES DE CLASE:
Evaluación final de competencia. Favor estudiar los temas vistos.
Octubre 26 de 2017
Resolver en clase la actividad pendiente de la clase anterior:
En la gráfica 1 y 2 Indique
1. la presencia de cada estado
Octubre 19 de 2017
Observa la curva de calentamiento de agua y resuelve las siguientes preguntas:
Ingresa desde casa al siguiente link para tener un poco más claro lo que se realizará en clase.
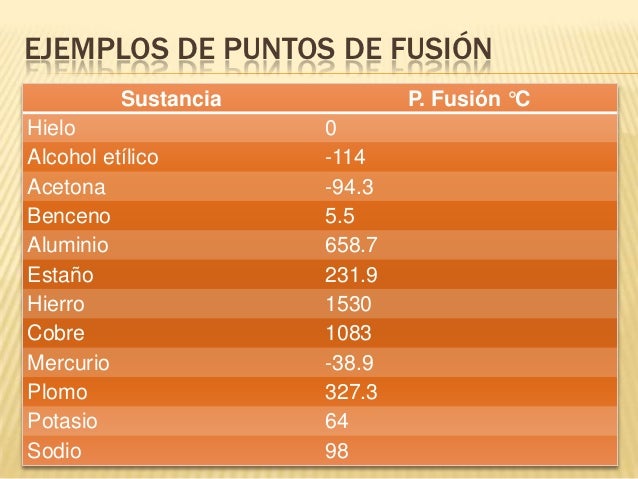
Con los puntos de fusión y ebullición de las 5 sustancias consultadas y en compañía de tu docente, resuelve:
1. Realiza las gráficas de curvas de calentamiento de sustancias consultadas
2. Que es una curva de calentamiento
3. En que regiones aparecen los estados sólido, líquido y gaseoso de la
4. Que representan las líneas horizontales de la gráfica, que sucede en ellas
En la gráfica 1 y 2 Indique
1. la presencia de cada estado
2. Rangos de temperatura de cada estado
3. Puntos de fusión y ebullición
Gráfica 1 curva de calentamiento sustancia desconocida X
Gráfica 2 curva de enfriamiento sustancia desconocida Y
Explicación de las curvas de calentamiento y enfriamiento. Favor copiar la siguiente hoja o imprimirla y pegarla al cuaderno.
Octubre 19 de 2017
No se programan actividades ya que se trabajará solo biología.
Estudiar para quiz de los temas vistos.
Octubre 12 de 2017
Octubre 5 de 2017
Hola estudiantes.
Lamento no felicitar al grupo expositor; cuando se confía y no salen las cosas como se esperan se pierde la confianza y credibilidad, ya que se asume que es el mayor curso que tiene la institución. Ante cualquier acción sea positiva o negativa debemos estar dispuestos a recibir premios o castigos, por favor reflexionar.
El llamado de atención también es para un pequeño grupo de estudiantes por el comportamiento asumido en las exposiciones, por la falta de atención e incluso la indisciplina. Jóvenes no olviden que cada momento y espacio es único y en el caso particular ustedes eran el ejemplo para los demás estudiantes, pero lamentablemente mostraron todo lo contrario. Ante cualquier acción sea positiva o negativa debemos estar dispuestos a recibir premios o castigos, por favor reflexionar. En clase se harán las recomendaciones para tener en cuenta como crítica constructiva.
Unas felicitaciones enormes a Aura Lucía Medina y Ana Zharihe Morales Fayad y de igual manera a las Madres de Familia por el compromiso adquirido en la decoración del evento, mil gracias por regalarme tantas satisfacciones.
Gracias ..........................
ANA VALENTINA AMADO MEJÍA , MARIA VICTORIA BARRERO OLIVEIRA y a ANA SOFIA REYES por la excelente presentación en la CIENCIA ROSARISTA.
Enamoraron a todos los asistentes. Me siento orgullosa de ustedes, por la calidad de exposición realizada, no hay duda del enorme aprendizaje adquirido. Sigan demostrando las habilidades y el compromiso con la Química.
Actividades para resolver en casa:
Consulta los puntos de fusión y ebullición de 5 sustancias puras.
ACTIVIDADES DE CLASE:
Socialización de la actividad extraclase.
Observa la curva de calentamiento de agua y resuelve las siguientes preguntas:
Con los puntos de fusión y ebullición de las 5 sustancias consultadas y en compañía de tu docente, resuelve:
1. Realiza las gráficas de curvas de calentamiento de sustancias consultadas
2. Que es una curva de calentamiento
3. En que regiones aparecen los estados sólido, líquido y gaseoso de la
4. Que representan las líneas horizontales de la gráfica, que sucede en ellas
En la gráfica 1 y 2 Indique
1. la presencia de cada estado
2. Rangos de temperatura de cada estado
3. Puntos de fusión y ebullición
Gráfica 1 curva de calentamiento sustancia desconocida X
Gráfica 2 curva de enfriamiento sustancia desconocida Y
Práctica de laboratorio para el próximo 2 de agosto, favor imprimir y pegar en el cuadernillo de laboratorio.
Septiembre 27 de 2017
Hola estudiantes.
No se programan actividades ya que tenemos día de la ciencia. El día jueves no deben asistir.
Los espero dispuestos con las actividades asignadas.
Favor imprimir la siguiente hoja para ser resuelta el miércoles, a medida se presenten los proyectos:
Nombre del proyecto
|
Para qué (Objetivos)
|
Cómo (procedimiento)
|
Olimpiada del Saber:
MATIZ RODRIGUEZ NICOLE DAYANA
Para exposición de proyecto:
Preparar la exposición sobre las leyes de los Gases
CARTAGENA ROJAS JHON ALEXANDER
NAVARRO RAMIREZ JUA JOSE
RODRIGUEZ ROY SANTIAGO
Los demás estudiantes deben organizar la decoración del sitio.
Para las actividades del Colegio El Rosario a realizarse el próximo lunes 25 de septiembre, del cual están cordialmente invitados, participarán:
Para la Olimpiada del SABER en QUÍMICA:
AMADO MEJÍA ANA VALENTINA (Hacer un repaso a los temas vistos en este año)
Para exposición de proyecto:
BARRRO OLIVEIRA MARIA VICTORIA
REYES ANA SOFIA
(preparar la exposición de la Técnicas de Reproducción en las plantas)
Septiembre 21 de 2017
Actividades de Clase:
A continuación relaciono las competencias del segundo período, por favor copiarlas en el cuaderno o imprimirlas y pegarlas en el cuaderno.
GIMNASIO PEDAGÓGICO NOVA ESTRELLA
IV Periodo
Química
Grado Octavo
Competencias:
Interpreta los resultados de experimentos en los que se observa la influencia de la variación de la temperatura (T) y la presión (P) en los cambios de estado de un grupo de sustancias, representándolos mediante el uso de gráficos y tablas.
Explica la relación entre la temperatura (T) y la presión (P) con algunas propiedades (densidad, solubilidad, viscosidad, puntos de ebullición y de fusión) de las sustancias a partir de ejemplos.
Asumo los valores de: responsabilidad, equidad, tolerancia y respeto dentro y fuera del aula.
Conocimientos:
Propiedades fisicoquímicas de las sustancias:
Solubilidad, viscosidad, densidad, puntos de fusión y puntos de ebullición.
Factores que afectan las propiedades fisicoquímicas de las sustancia.
Orientador
Lic. Astrid Cardoso Contreras
Para que nuestros estudiantes, brillen por la inteligencia de su mente y de su corazón
Actividades de clase:
1° Socialización del desempeño alcanzado en el tercer período.
2° Presentación de las competencias y contenidos del cuarto período.
3° Resolver las siguientes preguntas de inducción al tema:
a. Sustancias como el agua, la margarina de cocina, el chocolate, el hierro, entre otras se encuentran en fase sólida o estado sólido. De las anteriores sustancias, cuáles cambian de fase con un calentamiento leve?
b. Qué sustancias requieren altas temperaturas para lograr el cambio de fase?
c. Cuándo se dispone de una bebida a temperatura ambiente, por ejemplo a 20°C y si se desea fría, ¿qué se hace para enfriarla en pocos segundos? Por qué?
5° Interprete la siguiente información y resuelva:
Sustancia
|
Temperatura
|
Estado
|
5° Copie la imagen e Interprete la información suministrada y resuelva:
Elabore la gráfica que represente esta variación.
Con base en la siguiente tabla, gráfica estos valores e indica a qué temperatura ebulle el líquido.
6° Explicación del tema, apoyado en la siguiente información:
Actividades extraclase:
Completa la información solicitada en la siguiente tabla y estudia para quiz en la siguiente clase.
Septiembre 14 de 2017
Actividades de Clase:
Sigo esperando mi premio.
ACTIVIDADES DE CLASE:
Evaluación de la dimensión formativa. Favor llevar diligenciado en el cuaderno la auto evaluación y coevaluación, teniendo en cuenta el siguiente formato:
.
Criterio
|
Autoevaluación
|
Coevaluación
|
Heteroevaluación
| |
1
|
Cumplo con la presentación oportuna de tareas y trabajos.
| |||
2
|
Presento buena disposición en clase, soy atento y participativo.
| |||
3
|
Mantengo buena disciplina durante la clase.
| |||
4
|
Acato los normas de presentación personal establecidas por la Institución.
| |||
5
|
Soy ordenado y aseado con mi entorno.
|
Total:
A continuación relaciono la nota promedio que a la fecha tiene cada uno de ustedes. Aclaro que falta la nota de la autoevaluaión, coevaluación y heteroeevaluación.
Por favor los estudiantes que presentan desempeño básico y bajo estudiar para evaluación final de período, ya que con ella espero que la aprueben y recuperen. Los demás estudiantes no la presentan.
AMADO MEJIA ANA VALENTINA 4,722222222
BARRERO OLIVEIRA MARIA VICTORIA 4,461111111
CARTAGENA ROJAS JHON ALEXANDER 4,688888889
MORALES FAYAD ANA ZHARIHE 3,6
MATIZ RODRIGUEZ NICOLE DAYANA 4,655555556
MEDINA GONZALEZ AURA LUCIA 4,416666667
NAVARRO RAMIREZ JUAN JOSE 3,205555556
REYES ANA SOFIA 4,133333333
RODRIGUEZ ROY SANTIAGO 3,433333333
TELLO FONSECA MARIA ALEJANDRA 4,25
VERA SANTAMIRA PAULA ANDREA 3,327777778
Septiembre 07 de 2017
Actividades de Clase:
Muchachos les gane la apuestaaaaaaaaa, espero mi premio.
Quiz del tema: Presiones parciales. Favor estudiar.
Favor imprimir o anotar en el cuaderno la siguiente actividad para ser resuelta en clase:
Agosto 31 de 2017
Actividades de Clase:
Explicación de las leyes:
Presiones parciales
Combinada
Gases ideales
Desarrollo de taller propuesto por la docente.
Quiz de lo explicado.
Agosto 24 de 2017
Actividades de Clase:
Evaluación de los temas vistos. Favor estudiar
Revisión del cuaderno de ortografía y caligrafía
No hay actividades extraclase.
Agosto 17 de 2017
Actividades de Clase:
Resolver las actividades relacionadas en el siguiente link:
Organizados en grupos resolver las preguntas propuestas por la docente.
Evaluación de los temas vistos. Favor estudiar
NOTA:
El próximo 24 de agosto se revisará el cuaderno de ortografía solicitado en clase, con las palabras resaltadas por estar mal escritas. Recordar que cada término debe ser consultado su significado y escribir ocho oraciones con cada término.
No hay actividades extraclase.
Agosto 10 de 2017
Actividades de Clase:
En clase vamos a experimentar la ley de charles:
Organizados en los grupos de tres estudiantes traer los siguientes materiales:
1 Beaker 250 ml
1 Tubo de ensayo
1 Mechero de alcohol
Alcohol
1 Beaker 250 ml
1 Tubo de ensayo
1 Mechero de alcohol
Alcohol
Mechas para el mechero
4 globos medianos
5 cubos de hielo
Termómetro de laboratorio
1 hoja milimetrada
Actividad extraclase:
Resolver en el cuaderno, acompañado del procedimiento:
Una determinada cantidad de neón ocupa 0,3 litros a 200ºC. Calcular el volumen que ocuparía a 0ºC si la presión se mantiene constante.
Una determinada cantidad de oxígeno ocupa 2,5 litros a 50ºC. Calcular la temperatura a la que ocupará 1 litro.
Si tenemos un gas que a 10 grados centígrados ocupa 2.4 litros, calcular la temperatura final, si al terminar ocupa 2.15 litros.
Se encuentran 6 litros de un gas ideal a 24 ºC y presión constante. ¿Cuánto disminuye su temperatura para que su volumen sea de 4 litros?
Una masa de oxígeno ocupa 200 mL a 100°C. Determine su volumen a 0°C, si la presión se
mantiene constante.
El volumen inicial de una cierta cantidad de gas es de 200 mL a la temperatura de 293,15 K.
Calcule el volumen del gas si la temperatura asciende a 363,15 K y la presión se mantiene
constante
Una cantidad fija de gas a 296,15 K ocupa un volumen de 10,3 Litros, determine la temperatura
final del gas si alcanza un volumen de 23,00 L a presión constante.
Agosto 3 de 2017
Hola Chicos
Actividades de clase:
Quiz de los temas vistos. Favor estudiar.
Ingresar al siguiente link y copiar en el cuaderno la actividad allí propuesta. No se admite impresa la actividad, ya que es mi deseo que ustedes mejoren la letra y la ortografía.
Esta actividad será resuelta en clase:
Trae lo siguientes materiales: Jeringa y globo pequeño, solicitados a continuación:
HOLA CHICOSS
YA SE ABRIÓ LA CONVOCATORIA PARA REGISTRASE Y PRESENTAR LAS PRUEBAS SUPERATE 2.0, DESEO QUE SE INSCRIBAN Y LA PRESENTEN EN LA FECHA INDICADA. ANIMO.
27-07-17
Hoy no veremos química, ya se dedicarán las horas a estudiar biología, sin embargo tienes actividad extraclase, que debes presentar en esta clase:
Consulta el autor, la descripción y el funcionamientos de los siguientes aparatos:
Barómetro
Manómetro
Dial
Termómetro
Probeta
Balanza
13-07-17
Hola queridos estudiantes:
A continuación relaciono las competencias del tercer período, por favor copiarlas en el cuaderno o imprimirlas y pegarlas en el cuaderno.
GIMNASIO PEDAGÓGICO NOVA ESTRELLA
III Periodo
Química
Grado Octavo
Desempeños:
Comprende que el comportamiento de un gas ideal está determinado por las relaciones entre Temperatura (T), Presión (P), Volumen (V) y Cantidad de sustancia (n).
Interpreta los resultados de experimentos en los cuales analiza el comportamiento de un gas ideal al variar su temperatura, volumen, presión y cantidad de gas, explicando cómo influyen estas variables en el comportamiento observado.
Asumo los valores de: responsabilidad, equidad, tolerancia y respeto dentro y fuera del aula.
Conocimientos:
Gases
Variables que afectan el estado gaseoso
Orientador
Lic. Astrid Cardoso Contreras
Para que nuestros estudiantes, brillen por la inteligencia de su mente y de su corazón
Actividades de clase:
1° Socialización del desempeño alcanzado en el segundo período.
2° Presentación de las competencias y contenidos del tercer período.
3° Analizar y responder con la ayuda de ejemplos la siguiente pregunta:
¿Qué
características determinan el estado de agregación de las sustancias que están
en nuestro entorno?
Qué
sucede con las fuerzas de cohesión y las
de repulsión cuando el agua líquida se evapora? Explique
Completar:
Utiliza las palabras mayor, menor o igual para completar los siguientes
espacios:
Estado
|
Fuerzas
de repulsión
|
Fuerzas
de cohesión
|
Sólido
|
||
Líquido
|
||
Gaseoso
|
¿Cuál es la relación de las variables presión (P), temperatura (T), volumen (V) y cantidad de gas (n) con su comportamiento físico (difusión, compresión, dilatación, fluidez)?
4° Explicación del tema: Propiedades del estado gaseoso y su relación con las fuerzas intermoleculares
8-06-17
ACTIVIDADES DE CLASE.
Prácticas de laboratorio. Favor llevar el material solicitado desde clase.
ACTIVIDAD EXTRACLASE:
Ingresar a la página registrada a inicio de año:
https://miltonochoa.com.co/home/index.php y resuelve una prueba, luego imprime tu resultado y pegalo al cuaderno.. Relaciono pantallazos para tener en cuenta al ingresar a la página:
Evaluación de la dimensión formativa. Favor imprimir o copiar en el cuaderno el siguiente formato y traerlo diligenciado para la clase.
Criterio
|
Autoevaluación
|
Coevaluación
|
Heteroevaluación
| |
1
|
Cumplo con la presentación oportuna de tareas y trabajos.
| |||
2
|
Presento buena disposición en clase, soy atento y participativo.
| |||
3
|
Mantengo buena disciplina durante la clase.
| |||
4
|
Acato los normas de presentación personal establecidas por la Institución.
| |||
5
|
Soy ordenado y aseado con mi entorno.
|
Total:
1-06-17
Prácticas de laboratorio.
Favor esperar hasta el próximo 27 de mayo para que las impriman y lleven los materiales según los dos grupos organizados por las directivas.
25 g de manteca
1 mechero de alcohol
Alcohol
Sal
Papel filtro
1 lb de yeso blanco
1 lb de vaselina
1 lb de parafina
anilina
Recipiente metálico (ollita)
Favor ingresar al siguiente link:
Mide tus conocimientos y resuelve con honestidad las siguientes preguntas:
15,16,17,18, 27,28,29,31,38 y 45
No es necesario imprimir las preguntas, solo anota en el cuaderno el tiempo empleado y el número de preguntas acertadas.
En el colegio deberás sustentar en forma escrita una de estas preguntas seleccionada al azar. Así que prepárate bien desde casa. Animó, Te invito a que te la juegues por el SABER.
En el colegio deberás sustentar en forma escrita una de estas preguntas seleccionada al azar. Así que prepárate bien desde casa. Animó, Te invito a que te la juegues por el SABER.
25-05-17
Evaluación oral de cationes y aniones.
Explicar los cálculos mol-mol y mol-masa
Continuar explicando el tema de cálculos esteqiométricos apoyado en el siguiente link:
Desarrollo de los ejercicios propuestos en el siguiente link, favor traerlo impreso:
18-05-17
Se trabajarán las actividades pendientes por resolver de la semana antepasada.
No olvidar estudiar los cationes y aniones.
Continuar explicando el tema de cálculos esteqiométricos apoyado en el siguiente link:
Desarrollo de los ejercicios propuestos en el siguiente link, favor traerlo impreso:
Llevar los siguientes materiales: Por código de lista:
6 huevos
1 fco pequeño de aceite de cocina
1/2 libra de sal
1 caja pequeña de maizena
4 barras de chocolate
1 bolsa grande de leche
$3000 de Pan
1 libra de queso
12 Platos plásticos
12 vasos desechables
12 cucharas plásticas
11-05-17
Se trabajarán las actividades programadas para la semana pasada.
04-05-17
Realizar las actividades programadas para la clase pasada:
ACTIVIDADES DE CLASE:
Quiz del tema: Cationes-Aniones-Sales. Favor estudiar
Revisión del protocolo experimental
Repaso funciones de la química inorgánica.
Continuar explicando el tema de cálculos esteqiométricos apoyado en el siguiente link:
Desarrollo de los ejercicios propuestos en el siguiente link, favor traerlo impreso:
27-04-17
ACTIVIDADES DE CLASE:
Quiz del tema: Cationes-Aniones-Sales. Favor estudiar
Revisión del protocolo experimental
Socialización de la actividad optativa
Repaso funciones de la química inorgánica.
20-04-17
Hola queridos estudiantes:
A continuación relaciono las competencias del segundo período, por favor copiarlas en el cuaderno o imprimirlas y pegarlas en el cuaderno.
GIMNASIO PEDAGÓGICO NOVA ESTRELLA
II Periodo
Química
Grado Octavo
Desempeños:
Comprende que en una reacción química se recombinan los átomos de las moléculas de los reactivos para generar productos nuevos, y que dichos productos se forman a partir de fuerzas intramoleculares (enlaces iónicos y covalentes).
Comprende y realiza cálculos estequiométricos, en la solución de problemas, aplicando los principios
de las leyes ponderales.
Experimenta las reacciones químicas del diario vivir y realiza cálculos matemáticos en la predicción de cantidad de reactivos a emplear y productos a obtener.
Asumo los valores de: responsabilidad, equidad, tolerancia y respeto dentro y fuera del aula.
Conocimientos:
Leyes ponderales
Cálculos estequiométricos
Mol-mol
Mol-masa
Masa-masa
Reactivo límite
Pureza
Orientador
Lic. Astrid Cardoso Contreras
Para que nuestros estudiantes, brillen por la inteligencia de su mente y de su corazón
Actividades de clase:
1° Socialización del desempeño alcanzado en el primer período.
2° Presentación de las competencias y contenidos del segundo período.
3° Observa cada una de las siguientes imágenes y resuelve lo solicitado a continuación:
Figura-Proceso
|
Nombre de reactivos
|
Fórmula de reactivos
|
Nombre de productos
|
Fórmula de productos
|
Ecuación química
|
A
|
|||||
B
|
|||||
C
|
|||||
D
|
|||||
E
|
|||||
F
|
Repaso de cationes y aniones.
Favor estudiar.
ACTIVIDAD EXTRACLASE: Para el 27 de abril
ACTIVIDAD OPTATIVA:
El próximo 22 de abril se celebra el día mundial de la Tierra y es mi deseo como ser vivo involucrarlos a ustedes que también son seres vivos en sencillas actividades que les recuerden ese compromiso con la madre tierra
El Día Internacional de la Madre Tierra (Earth Day) se celebra el 22 de Abril de 2017. En esta fecha se intenta concienciar al mundo de la necesidad de proteger el medio ambiente y de la conservación de la biodiversidad. Así como paliar la superpoblación, la contaminación y hacer un uso responsable de los recursos naturales. Para ello todos los años las Naciones Unidas saca un lema y en numerosos países se realizan actividades de concienciación como conferencias, plantación de árboles, caminatas y actividades relacionadas con la ecología.
El Lema para el día de la Tierra en el año 2017 es el siguiente:
«Alfabetización Ambiental y Climática» (Environmental and Climate Literacy)
Nuestro planeta tierra en cifras:
- Surgió hace más de 4.500 millones de años aproximadamente, junto con los demás planetas del sistema solar
- Mide 12.713 km. de diámetro de polo a polo y 12.756 por el Ecuador. Por ello tiene forma esférica, ligeramente achatada en los polos y ensanchada en el Ecuador
- La superficie terrestre es de 510 millones de Km 2 aproximadamente.
- El volúmen total de agua de la tierra se estima en 1.420 millones de kilómetros cúbicos, incluyendo la contenida en ríos, lagos, hielo, océanos, atmósfera y el subsuelo.
- El volumen total de la tierra es de 1.083 mil 320 millones de kilómetros cúbicos.
- El punto más alto de la tierra es el Monte Everest con 8.848 m. La mayor depresión es el Mar Muerto, un mar interior cuya superficie está a 399 m. bajo el nivel del mar.
- Posee más de 6.000 millones de personas, la mitad de los cuales tiene menos de 25 años.
- Da un giro completo alrededor del sol en 365 días, 6 horas, 9 minutos y 9 segundos (aproximadamente un año)
- Gira sobre si misma en 23 horas, 56 minutos y 4 segundos (aproximadamente un día)
- Su velocidad promedio en el universo es de 30 km. por segundo.
Algunos de sus principales males:
- Reducción de la Capa de Ozono, causado por contaminantes que son arrojados en la atmósfera, particularmente gases refrigerantes, CFCs
- Lluvia Acida, causada por el dióxido de azufre de las industrias, afectando la composición del suelo y las aguas, afectando la vida sobre el planeta.
- Basura, acumulándose en todos los espacios del planeta
- Contaminación sónica, afectando a millones de personas, causando hipertensión arterial, ulceras, sordera, gastritis y hasta impotencia sexual.
- Contaminación de los suelos, por toneladas de plaguicidas, residuos tóxicos y desechos petroleros y mineros.
- Contaminación atmosférica, millones de vehículos aportan día a día toneladas de gases que deterioran la calidad del aire y lo hacen menos respirable
- Explosión demográfica. Cada día nacen alrededor de 250 mil niños en el mundo y cada año la población aumenta en 80 millones de seres humanos.
- Deforestación. Cerca de 170 mil km 2 de bosques desaparecen anualmente.
- Extinción de Especies. Alrededor del 15% de las aves y del 25% de los mamíferos del planeta se encuentran amenazados
- Tráfico de Especies, convertido en el tercer negocio más lucrativo del mundo, ha acabado con miles de especies animales y vegetales.
- Contaminación de las aguas, por un manejo inadecuado de los desechos, aguas servidas, plaguicidas y fertilizantes.
- Desertificación, buena parte del planeta comienza a transformarse en desiertos, con el subsiguiente agotamiento de los recursos que inci de en las probabilidades de obtener alimentos nutritivos.
Como puedes participar?:
Con todas o cualquiera de las siguientes actividades:
Reciclatón: Campaña a realizar en la casa o en colegio durante el descanso.
Elementos a reciclar: Papel y botellas
Implementos: Bolsa verde para reciclar el papel y negra para las botellas
Llevar las bolsas con lo reciclado al colegio en la hora de clase para ser vendido y con el dinero comprar una planta y su matera para donarla al colegio.
Pinta Verde: Diseña el logo original para la celebración del día de la tierra 2017, enfatizando el tema o problemática central, antes expuesta. Puedes elaborarlo en el material que desees. Animo.
13-04-17
Hola queridos estudiantes.
Disfruten de la Semana Santa.
06-04-17
ACTIVIDAD EXTRACLASE:
Ingresar a la página de https://miltonochoa.com.co/home/index.php y resolver uno de los cuestionarios propuestos para el grado noveno, sin importar los temas que evalúen, luego toma pantallazo a los resultados logrados sin importar la calificación obtenida. Imprime y pega en el cuaderno el resultado. Lo importante es que practiques en casa este tipo de pruebas. Recuerda que desde febrero se solicito la inscripción a esta página.
Balancear por oxido-reducción 5 ecuaciones de las publicadas la semana pasada.
Con base en la información de los cuadros siguientes, responda las preguntas que se formulan a continuación
1
0
|
2
Reducción
|
3
Na
|
4
-2
|
5
O2
|
6
Síntesis
|
7
Oxidación
|
8
Na2O
|
a. Diga en qué casillas están los elementos que tienen el estado de oxidación que aparece en las casillas 1 y 4
b. Escriba la ecuación química con base en los símbolos de los elementos respectivos y la fórmula del compuesto que aparece en la rejilla.
c. Escribe una frase en la que incluya los términos que aparecen en las casillas 2 y 7
d. Escriba una frase con sentido químico con el término de la casilla 6
ACTIVIDADES DE CLASE:
Evaluación final de período. Favor estudiar los temas vistos.
Evaluación de la dimensión formativa. Favor imprimir o copiar en el cuaderno el siguiente formato y traerlo diligenciado para la clase.
Criterio
|
Autoevaluación
|
Coevaluación
|
Heteroevaluación
| |
1
|
Cumplo con la presentación oportuna de tareas y trabajos.
| |||
2
|
Presento buena disposición en clase, soy atento y participativo.
| |||
3
|
Mantengo buena disciplina durante la clase.
| |||
4
|
Acato los normas de presentación personal establecidas por la Institución.
| |||
5
|
Soy ordenado y aseado con mi entorno.
|
Total:
Socialización de los desempeños logrados en el primer período.
Entrega de actividades de nivelación para los estudiantes con desempeño Bajo, para ser entregados y sustentados después de semana Santa.
30-03-17
ACTIVIDAD EXTRACLASE:
Escribe los estados de oxidación a cada una de las siguientes fórmulas. Recuerda lo explicado en clase.
|
Ingresar al siguiente link e imprime las páginas allí indicadas para explicar los siguientes pasos del método de balanceo por oxido-reducción.
http://academicoalbertocastro9.blogspot.com.co/2013/06/taller-de-balanceo-de-ecuaciones-por.html
23-03-17
ACTIVIDADES DE CLASE:
Quiz de los números de oxidación. Favor estudiar.
Se continua explicando el balanceo por oxido-reducción.
No hay actividades extraclase.
16-03-17
ACTIVIDADES DE CLASE:
Evaluación del tema:
Tipos de reacciones
Balanceo de ecuaciones por tanteo
Favor estudiar.
ACTIVIDAD EXTRACLASE:
Terminar en casa las tablas con los números de oxidación. Favor estudiarlos.
09-03-17
La jornada tarde es un poco pesada, pero no quiero verlos perezosos y poco interesados en las actividades de la clase. Animo, aún les falta mucho camino por recorrer.
ACTIVIDADES EXTRACLASE:
Resuelve en casa la actividad propuesta la semana pasada para la clase:
Clasifica las siguientes ecuaciones, según corresponda a reacciones de combinación, descomposición, neutralización, desplazamiento, etc.
1. N2 + 3 H2 -------------------- 2NH3
2. CaCl2 + 2NaOH -------------- Ca(OH)2 + 2NaCl
3. 2NaHCO3 -------------------- Na2CO3 + HOH + CO2
4. 2NO + O2 -------------------- 2NO2
5. Na2CO. 10 H2O -------------- Na2CO3 + 10 H2O
6. FeCL3 + H2SO4 ------------ Fe2 (SO4)3 + 6HCl
7. H2SO4 + 2NaOH ------------ Na2SO4 + H2O
8. C6H12O6 ---------------------- 2C2H5OH + 2CO2
9. C + O2 ----------------------- CO2
10. CaCO3 ------------------------ CaO + CO2
11. NaOH + HCl------------------ NaCl + HOH
12. SO3 + HOH ------------------- H2SO4
Completa la siguiente información:
No. reactivos
|
Fórmula de reactivo 1
|
Fórmula de reactivo 2
|
No. de productos
|
Fórmula de producto 1
|
Fórmula de producto 2
|
Tipo de reacción
|
Termina en casa la actividad iniciada en la clase pasada.
Estudia para quiz del tema. Favor dedícale tiempo y prepárate.
02-03-17
Desarrollo de las actividades propuestas para el 23-02
23-02-17
Actividades de clase:
Clasifica las siguientes ecuaciones, según corresponda a reacciones de combinación, descomposición, neutralización, desplazamiento, etc.
1. N2 + 3 H2 -------------------- 2NH3
2. CaCl2 + 2NaOH -------------- Ca(OH)2 + 2NaCl
3. 2NaHCO3 -------------------- Na2CO3 + HOH + CO2
4. 2NO + O2 -------------------- 2NO2
5. Na2CO. 10 H2O -------------- Na2CO3 + 10 H2O
6. FeCL3 + H2SO4 ------------ Fe2 (SO4)3 + 6HCl
7. H2SO4 + 2NaOH ------------ Na2SO4 + H2O
8. C6H12O6 ---------------------- 2C2H5OH + 2CO2
9. C + O2 ----------------------- CO2
10. CaCO3 ------------------------ CaO + CO2
11. NaOH + HCl------------------ NaCl + HOH
12. SO3 + HOH ------------------- H2SO4
Completa la siguiente información:
No. reactivos
|
Fórmula de reactivo 1
|
Fórmula de reactivo 2
|
No. de productos
|
Fórmula de producto 1
|
Fórmula de producto 2
|
Tipo de reacción
|
1. Describa con frases y, luego, con ecuación química la reacción que se produce en el estomago entre los jugos gástricos y una tableta antiácida preparado a base de carbonato de calcio CaCO3.
2. Expresa la reacción que se describe a continuación en una ecuación química
La combustión del gas propano o de cocina implica la reacción entre el propano y el oxígeno del aire para producir dióxido de carbono, agua y calor
3. Exprese mediante ecuaciones químicas las reacciones que se describen a continuación. Identifique reactivos y productos.
a) El carbón sólido reacciona con oxígeno para formar dióxido de carbono gaseoso.
b) La formación de la lluvia ácida implica la reacción del trióxido de azufre con el agua para producir ácido sulfúrico.
c) Cuando se mezcla una solución de cloruro de sodio con otra de nitrato de plata se forma cloruro de plata y nitrato de sodio.
d) Cuando el gas butano, C4H10 de un encendedor de bolsillo para cigarrillos arde en el aire, se producen dióxido de carbono y agua.
e) La acetona C3H6O, es un componente importante del removedor barniz de uñas. Escribe una ecuación que describa la combustión completa de la acetona con producción de dióxido de carbono y agua.
Actividad Extraclase:
Resolver en el cuaderno:
1. ¿Qué crees que ocurre cuando colocas una pastilla efervescente dentro de un vaso con agua? Describe y explica el fenómeno observado.
2. ¿Qué consideras que es una reacción química? Explica con un ejemplo.
3. ¿Crees que todas las reacciones químicas son iguales? Menciona los criterios en que apoyas tu respuesta.
4. A partir de la información de la rejilla, precise:
1
NaOH
|
2
Ba(NO3)2
|
3
Ba(OH)2
|
4
BaSO4
|
5
H2SO4
|
6
HCl
|
a. Formule la ecuación para obtener la sustancia de la casilla 4.
b. ¿Qué sustancia falta en la rejilla que, mezclada con la sustancia de la casilla 3, produce el nitrato de la casilla 2?
c.  ¿Cuáles son los productos de la reacción entre las sustancias de las casillas 1 y 6?
¿Cuáles son los productos de la reacción entre las sustancias de las casillas 1 y 6?
d. ¿Qué casillas contienen fórmulas que representan ácidos?
5. Explique por que la sal que se representa en la casilla 4 es neutra.
16 de febrero de 2017
Actividades de clase.
Resolver las actividades programadas para la clase anterior.
Estudiar los 40 primeros elementos de la tabla periódica.
Aún no se publica la guía de laboratorio.
9 de Febrero de 2017
Hola queridos estudiantes espero hayan descansado lo necesario y vengan con todas las energías puestas, ya que les esperan muchísimos conocimientos para enriquecer el SABER.
GIMNASIO PEDAGÓGICO NOVA ESTRELLA
I Periodo
Del 1 de Febrero al 7 de Abril
QUÍMICA
Grado Octavo
Saber:
Balancea ecuaciones químicas, para identificar sustancias oxidadas, reducidas, agente oxidante y reductor, en una reacción química, basado en el método de REDOX, para resolver problemas del diario vivir
Hacer:
Clasifica reacciones químicas mediante el reconocimiento de reactivos y productos
Ser:
Buscar la excelencia en el desarrollo y presentación de tareas y trabajos.
Temas:
ECUACIONES, REACCIONES QUÍMICAS
Reacción Química
Ecuación Química
Clases de reacciones
Orientador
Lic. Astrid Cardoso Contreras
Unidos y motivados seguiremos adelante para ser cada día mejor en el SER, el HACER y en el SABER
Actividades de Clase:
Repaso del tema: Reacciones y ecuaciones químicas.
Resolver el siguiente taller:
1. REACCIONES QUÍMICAS
1.
Clasifica las siguientes reacciones:
A. ____________________________
NaOH + HI H₂O + NaI
B. ____________________________ I₂ + H₂ HI + Calor
B. ____________________________ I₂ + H₂ HI + Calor
C. ____________________________
CL2 + Fe Cl₂
Fe Cl₃ AH = 37 cal
D.
____________________________ Na CL + Fe
Fe Cl₃ +
Na AH = - 40 cal
2.
En la ecuación H₂SO4
+ H Br → SO₂
+ Br₂ + H₂O
la sustancia oxidada es:
A.
Bromo B. Azufre C. SO2
D. H Br
3.
La ecuación: Na OH + H
I → H₂O
+ NaI se clasifica como:
A.
Descomposición
B. Sustitución C. Doble
sustitución
D.
Combinación
4.
Durante una reacción el S cambia su número de oxidación
de +6 a -2, se
puede decir que el elemento en este proceso:
A.
Gana 4 e¯ B.
Pierde 4 e¯
C. Gana 8
e¯
D. Pierde 8 e¯
Desarrolle:
5.
Si Al +
Fe₂O₃ →
Al₂ O₃
+ Fe
A. Sustancia
oxidada
________________________________
B. Sustancia
reducida
________________________________
C. Agente
oxidante
________________________________
D. Agente
reductor
________________________________
E. Coeficiente
de balanceo ________________________________
F. Número de
electrones ganados ________________________________
G. Número de electrones
perdidos ________________________________
6- Resuelve e iguala las siguientes ecuaciones por
REDOX
A. Acido clorhídrico +
Hierro ® Cloruro ferroso +
Hidrógeno.
B. Nitrato de plata + Hierro ® Nitrato ferroso + Plata.
C. Sulfato cúprico + Aluminio ® Sulfato de aluminio + Cobre.
D. Acido nítrico + Potasio ® Nitrato de potasio + Hidrógeno.
E. Sulfato cúprico + Hierro ® Sulfato ferroso + Cobre.
F. Acido sulfúrico + Calcio ® Sulfato de calcio + Hidrógeno.
G. Nitrato plumboso + Zinc ® Nitrato de zinc + Plomo.
H. Acido bromhídrico + Zinc ® Bromuro de zinc + Hidrógeno.
I. Cloruro cúprico + Aluminio ® Cloruro de aluminio + Cobre.
J. Sulfato de magnesio + Sodio ® Sulfato de sodio + Magnesio.
B. Nitrato de plata + Hierro ® Nitrato ferroso + Plata.
C. Sulfato cúprico + Aluminio ® Sulfato de aluminio + Cobre.
D. Acido nítrico + Potasio ® Nitrato de potasio + Hidrógeno.
E. Sulfato cúprico + Hierro ® Sulfato ferroso + Cobre.
F. Acido sulfúrico + Calcio ® Sulfato de calcio + Hidrógeno.
G. Nitrato plumboso + Zinc ® Nitrato de zinc + Plomo.
H. Acido bromhídrico + Zinc ® Bromuro de zinc + Hidrógeno.
I. Cloruro cúprico + Aluminio ® Cloruro de aluminio + Cobre.
J. Sulfato de magnesio + Sodio ® Sulfato de sodio + Magnesio.
7.
Determine el balanceo por tanteo:
CaF2 +
H2SO4 ®
CaSO4 + HF
K
+ H2O ® KOH + H2


































Hola Victoria:
ResponderEliminarLo solicitado en el ejercicio es escribir los estados de oxidación, teniendo en cuenta las reglas vistas en clase. Por ej: Oxígeno es -2, el hidrogeno es +1, la suma de + y - : 0
Espero haber aclarado tu duda.