Noviembre 19 de 2017
Noviembre 15 de 2017
Hola mis queridos estudiantes.
El año escolar 2017 llego a su fin.
Gracias por otro año más de experiencias, risas, logros....
Las expectativas se cumplieron.
Sigan esforzándose cada día más. Pronto se acercan a otra etapa en la época escolar y esta requiere de mucho más atención, dedicación.... Sin embargo nunca pierdan ese entusiasmo y compañerismo que los destaca como grupo.Gracias padres de familia por el acompañamiento y apoyo incondicional.
Actividades de clase:
Evaluación de la dimensión formativa:
Favor traer diligenciada la autoevaluación y coevaluación.
Criterio
|
Autoevaluación
|
Coevaluación
|
Heteroevaluación
| |
1
|
Cumplo con la presentación oportuna de tareas y trabajos.
| |||
2
|
Presento buena disposición en clase, soy atento y participativo.
| |||
3
|
Mantengo buena disciplina durante la clase.
| |||
4
|
Acato los normas de presentación personal establecidas por la Institución.
| |||
5
|
Soy ordenado y aseado con mi entorno.
|
Total:
Organización del informe de la práctica de laboratorio realizada la semana pasada.
Evaluación final del año escolar. Favor estudiar. Esta la presentarán aquellos estudiantes cuyo promedio final este entre bajo o básico.
Favor tener las actividades al día ya que se revisará de nuevo.
Relaciono las notas a la fecha, faltando por registrar en planilla la auto evaluación, la coevaluación y la heteroevaluación y las demás actividades programadas para la clase, son:
ARTEAGA URUEÑA MARIA JOSE
|
4,2
|
BASTIDAS IBAGON MARIA
CAMILA
|
4,25454545
|
CARDOSO LEIDY SOFIA
|
3,49090909
|
CONDE GONZALEZ NICOLAS
|
3,5
|
DEVIA ARLEY FELIPE
|
3,70909091
|
MEJIA ALBERTO
|
3,91818182
|
NUÑEZ TOVAR ANDRES FELIPE
|
3,72727273
|
ORTIZ MARTINEZ LAURA SOFIA
|
3,69090909
|
RUEDA ERAZO BRAYAN STEVEN
|
3,50909091
|
SI EN LA NOTA FINAL QUE SE DARÁ EN LA CLASE, QUEDA ALGUN ESTUDIANTE CON DESEMPEÑO BAJO, ESTE SE CITARÁ PARA EL 22 DE NOVIEMBRE A LAS 2:00 P.M, CON LAS ACTIVIDADES DE CLASE Y EXTRA CLASE AL DÍA, CON LAS EVALUACIONES CORREGIDAS, ARGUMENTADAS Y ESTUDIADAS, PARA REALIZAR LA RESPECTIVA NIVELACIÓN.

Noviembre 8 de 2017
Actividades de clase:
Evaluación final de competencia. Favor estudiar
Práctica de laboratorio:
Reacciones químicas.
Llevar en los grupos de tres estudiantes los siguientes materiales:
Bicarbonato de sodio
Manguera de la empleada para canalizar o cuando nos aplican suero (20 cm)

Bandeja ancha
Plastilina o 5 Tapones de corcho que se ajusten a la boca de un tubo de ensayo.

En clase continuaremos resolviendo las preguntas de la fotocopia, por favor no olvidar la fotocopia entregada en la clase pasada.
No olvidar tener el cuaderno al día con las actividades de clase y extraclase de las fechas anteriores.
Noviembre 1 de 2017
Actividades de clase:
Hola Jóvenes.
En la clase se dispondrán de dos horas, que se requieren para reforzar los temas, sin embargo los invito que desde casa trabajen a las actividades que tienen pendiente por resolver de la clase del 18 y 25 de octubre, además tendremos evaluación escrita individual y otra por parejas.
Hola Jóvenes.
En la clase se dispondrán de dos horas, que se requieren para reforzar los temas, sin embargo los invito que desde casa trabajen a las actividades que tienen pendiente por resolver de la clase del 18 y 25 de octubre, además tendremos evaluación escrita individual y otra por parejas.
Octubre 25 de 2017
Actividades Extra clase:
Terminar de resolver los ejercicios iniciados en la clase pasada, excepto los que tengan paréntesis.Organizados en grupos de dos estudiantes resolver con argumentos una pregunta propuesta por la docente respecto al tema de balanceo de ecuaciones.
Estudiar para quiz.
Octubre 18 de 2017
Actividades de clase:
Quiz de los temas vistos. Favor estudiar.
Favor copiar en el cuaderno las siguientes ecuaciones dejando entre cada ecuación 5 renglones:
Octubre 11 de 2017
Hola estudiantes.
Octubre 4 de 2017
Hola estudiantes.
Felicitaciones a JAIME ALBERTO MEJIA, ARLEY FELIPE DEVIA y a ANDRES FELIPE NUÑEZ TOVAR por su esfuerzo, sin embargo hay aspectos por mejorar, que se evidenciaron y en clase se harán las recomendaciones para tener en cuenta como crítica constructiva.
Gracias ..........................
MARÍA CAMILA BASTIDAS IBAGON, MARIA JOSE ARTEAGA URUEÑA, LAURA SOFIA ORTIZ MARTINEZ por la excelente presentación en la Ciencia Rosarista.
Dejaron en alto el nombre del colegio, mostraron el sello de calidad y exigencia por hacer las cosas bien. Me siento orgullosa de ustedes. Sigan demostrando las habilidades y el compromiso con la Química.
ACTIVIDADES DE CLASE:
Revisión, socialización y valoración de la actividad extraclase (lluvia ácida, publicada el 20 de septiembre)
Explicación del tema: Balanceo de ecuaciones por Tanteo o Ensayo.
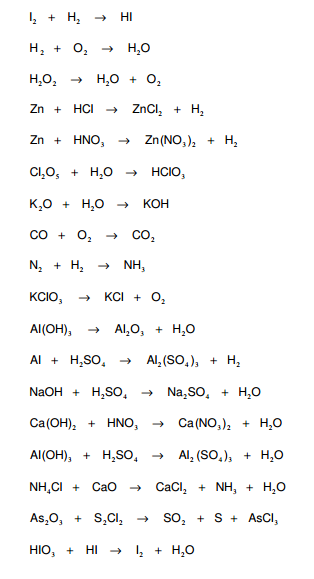
Balancear las siguientes ecuaciones:
Balancear las siguientes ecuaciones:

Se pasará al tablero para resolver los ejercicios. Favor a tender a las explicaciones.
ACTIVIDAD EXTRACLASE:
Clasifique las siguientes reacciones como uno de los cinco tipos de reacciones descritos.
a. 2 H2 + O2 à 2 H2O
b. H2CO3 + 2 Na à Na2CO3 + H2
c. Ba(OH)2 à H2O + BaO
d. Ca(OH)2 + 2 HCl à 2 H2O + CaCl2
e. CH4 + 2 O2 à CO2 + 2 H2O
f. 2 Na + Cl2 à 2 NaCl
g. Cl2 + 2 LiBr à 2 LiCl + Br2
|
¿Cuál de las siguientes ecuaciones representa la descomposición del cloruro de potasio?
a. K + Cl à KCl
b. 2 KCl + F2 à 2 KF + Cl2
c. KCl à K + Cl
d. 2 KCl à 2 K + Cl2
e. 2 KCl à K2 + Cl2
f. Ninguna de las anteriores
|
¿Cuál de las siguientes ecuaciones representa una reacción de neutralización?
a. 2 K + 2 HCl à 2 KCl + H2
b. KOH + HNO3 à KNO3 + H2O
c. K2SO4 + 2 NaOH à Na2SO4 + 2 KOH
d. Ca(OH)2 à H2O + CaO
e. Ninguna de las anteriores
|
Complete las siguientes reacciones adecuadamente y clasifíquelas.
a. CaO à
b. Na + F2 à
c. Al + Mg(NO3)2 à
d. HClO + LiOH à
e. C2H5OH + O2 à
f. HNO3 + Ca à
g. BaCl2 + Na2SO4 à
|
Septiembre 27 de 2017
Hola estudiantes.
No se programan actividades ya que tenemos día de la ciencia.
Los espero dispuestos con las actividades asignadas.
Favor imprimir la siguiente hoja para ser resuelta el miércoles, a medida se presenten los proyectos:
Nombre del proyecto
|
Para qué (Objetivos)
|
Cómo (procedimiento)
|
Olimpiada del Saber:
MEJIA JAIME ALBERTO
Para exposición de proyecto:
Indicador Casero: Preparar la col y emplear materiales de mayor uso: gaseosas (de varias marcas), agua de panela, chocolate, jugos (de varios tipos de frutas) y organizar la escala del PH.
DEVIA ARLEY FELIPE
NUÑEZ TOVAR ANDRES FELIPE
Para las actividades del Colegio El Rosario a realizarse el próximo lunes 25 de septiembre, del cual están cordialmente invitados, participarán:
Para la Olimpiada del SABER en QUÍMICA:
BASTIDAS IBAGON MARÍA CAMILA (Hacer un repaso a los temas vistos en este año)
Para exposición de proyecto:
ARTEAGA URUEÑA MARIA JOSE
ORTIZ MARTINEZ LAURA SOFIA
(preparar la exposición de Propiedades de la materia)
Septiembre 20 de 2017
Actividades de clase:
A continuación relaciono las competencias del cuarto período, por favor copiarlas en el cuaderno.
GIMNASIO PEDAGÓGICO NOVA ESTRELLA
IV Periodo
Química
Grado Séptimo
Desempeños:
Relaciona las ecuaciones químicas con la ley de la conservación de la materia para equilibrarlas e interpretarlas.
Clasificar experimentalmente reacciones químicas.
Fomenta el interés y el desarrollo de actitudes científicas hacia la investigación.
Asumo los valores de: responsabilidad, equidad, tolerancia y respeto dentro y fuera del aula.
Conocimientos:
Leyes ponderales
Reacciones y ecuaciones químicas
Clasificación de las reacciones
Balanceo de ecuaciones
Orientador
Lic. Astrid Cardoso Contreras
Para que nuestros estudiantes, brillen por la inteligencia de su mente y de su corazón
Actividades de clase:
1° Socialización del desempeño alcanzado en el cuarto período.
2° Presentación de las competencias y conocimientos del cuarto período.
3° Continuar explicando la formulación y nomenclatura de sales
4° Con los datos, la información y la explicación recibida en la clase anterior respecto a los indicadores de las funciones de la química mineral, responde:
consulta el PH de 20 sustancias que usas a diario y clasificalas en básicas o ácidas, organiza los datos en una tabla como la siguiente:
Sustancia
|
PH
|
Básica
|
Ácida
|
5° Realización de la actividad de inducción al tema:
Actividad de motivación:
Resolver:
Explica la función de los ácidos y las bases en procesos propios de los seres vivos (respiración y digestión en el estómago) y de procesos industriales (uso fertilizantes en la agricultura) y limpieza (jabón).
Observa la siguiente gráfica y luego resuelve:
Fuente:
1. Explica con tus propias palabras el proceso de formación de la lluvia acida.
2. El proceso de formación de la lluvia acida, es un ejemplo de reacción quimica? Por qué?
3. Que es una reacción química? De que está constituida? Explica con tus propias palabras
4. Qué diferencias hay entre reactivo y producto?
5. Cuáles son los reactivos y productos de la lluvia acida?. Escribe sus fórmulas y nombres.
6. Qué consecuencias tanto para la humanidad como para todo ser vivo conlleva la formación de la lluvia acida.
7. Consulta el nombre y la formula de los gases que contaminan la atmosfera. Como se forman? Escribe las reacciones químicas en cada caso.
8. Consulta y dibuja el mapamundi con los países de mayor índice de lluvia acida.
9. Por qué crees que se forma la lluvia acida? Como se puede evitar? Explica.
10. Indica alguna zona en que se este dando a menudo esta situación. ¿Por qué efectos pueden llegar a regiones muy distantes del punto o área de origen del fenómeno?
11. Señala algunas medidas concretas que faciliten una solución a este problema
12. Los óxidos de azufre y de nitrógeno se están emitiendo a la atmósfera, contaminando el aire de nuestro planeta y produciendo variados problemas ambientales
13. ¿Qué fuentes de producción de óxidos de nitrógeno conoces?
14. ¿De dónde proceden los óxidos de azufre?
15. ¿Qué les ocurre a estos gases cuando se encuentran en un ambiente húmedo?
16. ¿Cuándo estos contaminantes vuelven al suelo, cómo crees que afecta a los seres vivos y a su medio ambiente?
17. En muchos lugares del planeta, el pH de la lluvia es bastante ácido, debido a la presencia de ácido sulfúrico y nítrico, entre otras muchas sustancias de carácter ácido.
18. Explica cómo se forma el ácido sulfúrico en la atmósfera y escribe las reacciones químicas asociadas a dicho proceso.
19. Explica cómo se forma el ácido nítrico en la atmósfera y escribe las reacciones químicas asociadas a dicho proceso.
Reacción química y ecuación
Tipos de reacciones
Ley de la conservación de la materia
Balanceo de ecuaciones por Tanteo
Resolver:
1. Balancear las siguientes ecuaciones:
1. Fe2 (SO4)3 + KSCN à K3Fe (SCN) 6 + K2SO4
2. (NH4)2 CO3 à NH3 + CO2 + H2O
3. (NH4)2Cr2O7 à Cr2O3 + N2 + H2O
4. CaSiO3 + HF à H2SiF6 + CaF2 + H2O
5. P4O10 + Mg (OH)2 à Mg3 (PO4)2 + H2O
6. I2O5 + BrF3 à IF5 + O2 + BrF2
Septiembre 13 de 2017
Actividades de clase:
Revisión de la tarea propuesta para el 06 de septiembre.
Evaluación de competencia. Favor estudiar
Evaluación de la dimensión formativa. Favor llevar diligenciado en el cuaderno la auto evaluación y coevaluación, teniendo en cuenta el siguiente formato:
.
Criterio
|
Autoevaluación
|
Coevaluación
|
Heteroevaluación
| |
1
|
Cumplo con la presentación oportuna de tareas y trabajos.
| |||
2
|
Presento buena disposición en clase, soy atento y participativo.
| |||
3
|
Mantengo buena disciplina durante la clase.
| |||
4
|
Acato los normas de presentación personal establecidas por la Institución.
| |||
5
|
Soy ordenado y aseado con mi entorno.
|
Total:
Septiembre 06 de 2017
A continuación relaciono las actividades a realizar en clase:
Explicación del tema acidez y basicidad: Ph
Con los datos, la información y la explicación recibida en la clase anterior respecto a los indicadores de las funciones de la química mineral, responde:
consulta el PH de 20 sustancias que usas a diario y clasificalas en básicas o ácidas, organiza los datos en una tabla como la siguiente:
Sustancia
|
PH
|
Básica
|
Ácida
|
PRACTICA DE LABORATORIO:
Consigue cada una de las sustancias solicitadas en la siguiente tabla, excepto el hidróxido de sodio y el ácido nítrico.
Registra en el cuaderno la tabla para ser resuelta en clase:
Solicita a la docente tiras de papel tornasol. Impregna a cada sustancia y de acuerdo a la explicación de clasificalas según su composición en Ácidas, Básicas o Neutras. Consulta su fórmula molecular y representa su estructura.
SUSTANCIA
|
CARACTER
|
FORMULA
|
PH
| ||
ACIDO
|
BASICO
|
NEUTRO
| |||
Hidróxido de sodio
| |||||
Bicarbonato de sodio
| |||||
Vinagre
| |||||
Jugo de naranja
| |||||
Leche de Magnesia
| |||||
Decol
| |||||
Jabón
| |||||
Orines
| |||||
Jugo de limón
| |||||
Alka seltzer
| |||||
Hidróxido de sodio
| |||||
Ácido nítrico
| |||||
30-08-17
Espero que el incumplimiento en llevar los materiales solicitados no se repita, ya que salí muy triste al ver la poca importancia que le dieron a la realización de la práctica de laboratorio.
Actividades de clase:
Ingresar el día 30 de agosto a la página superate20.edu.co y presentar la prueba virtual.
Se realizará la actividad programada para el 16-08-17
Práctica de laboratorio
Llevar los siguientes materiales:
Mechero de alcohol
Alcohol
Mechas para el mechero
1 hoja de papel aluminio
1 sobre pequeño de azufre
Óxidos metálicos
- Primero debemos de encender el mechero de alcohol
- Después sostener con las pinzas el pedazo de magnesio obtendremos la formación del óxido de magnesio..
- Después con sostener con las pinzas el pedazo de aluminio y calentarlo por un rato,en este paso se formará el óxido de aluminio.
- Calentar el hierro en la cucharilla, retirarlo del fuego hasta que el hierro se torne a un color rojizo, es entonces cuando obtendremos el óxido de hierro.
- Calentar el zinc en la cucharilla hasta que este tome un color amarillento.
- Emplear el sodio para la obtención del óxido.
- Escribir las respectivas reacciones
- Tomar las tiras de papel tornasol y efectuar el reconocimiento con el indicador suministrado por la docente.
Óxido no metálico
- Ponemos el azufre en la cucharilla y lo calentamos por un rato hasta que se caliente bien. Y así tendremos formado el oxido de azufre.
- Escribir las respectivas reacciones
- Tomar las tiras de papel tornasol y efectuar el reconocimiento con el indicador suministrado por la docente.
23-08-17
Actividades de clase:
Revisión del cuaderno de ortografía
Práctica de laboratorio
Indicador casero
Observa de nuevo el vídeo ingresando al siguiente link, para que recuerdes aspectos importantes de la preparación del indicador y la escala del PH:
Para ello reúne en grupo de laboratorio el siguiente material y llévalo sin falta para la clase, no olvides la bata y guantes, ya que sin ellos sera imposible participar de la práctica. Recuerda que tu vales mucho.
Indicador casero preparado: 1 litro (recuerda que se prepara cocinando hojas de col morada, observa de nuevo el vídeo). Llévalo en una botella plástica.
10 vasos desechables trasparentes
Bicarbonato de sodio
Agua destilada
Vinagre
Jugo de limón
Jugo de naranja
Jugo de tomate
Café
Sal
Leche de magnesia
Jabón líquido
Recuerda llevar en pequeña cantidad estos materiales.
De igual manera lleva medio pliego de cartulina y colores para elaborar la escala del PH. En ella registraremos:
Sustancia
|
Color
|
PH
|
ACTIVIDAD EXTRACLASE:
Favor resolver en el cuaderno las siguientes actividades, por códigos, así: Sólo la actividad asignada, para ser explicada en clase.
Código 1 :
Completar la siguiente tabla:
Código 1 :
Completar la siguiente tabla:
Código 2 :
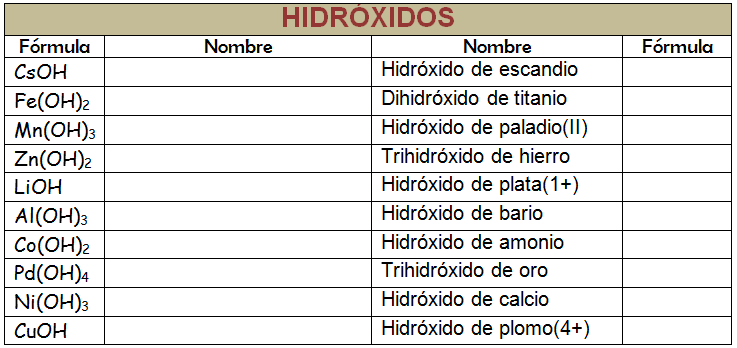
Nombre los siguientes compuestos, empleando las tres nomenclaturas vistas:
a. Sr(OH)2
b. Ni(OH)2
c. Al(OH)3
d. Pt(OH)4
e. NaOH
f. Ca(OH)2
g. Au(OH)3
h. RbOH
i. Cd(OH)2
j. Sn(OH)4
Código 3:
Completar la siguiente tabla
Fórmula química del hidróxido
|
Fórmula química del óxido del que se formó
|
N. Sistemática
Hidróxido
|
N. Tradicional Hidróxido
|
N. Stock Hidróxido
|
Sr(OH)2
| ||||
Trihidróxido de Indio
| ||||
TiO2
| ||||
Hidróxido platinoso
| ||||
Hidróxido de mercurio (II)
|
Código 4:
I. CON BASE EN LA INFORMACIÓN CONTENIDA EN LA REJILLA, COMPLETA LOS ENUNCIADOS PROPUESTOS
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
| ||||||||
Zn(OH)2
|
Cr(OH)6
|
PtO
|
Cu+1
|
PtO2
|
H2O
|
Sr(OH)2
|
Fe2O3
| ||||||||
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
| ||||||||
Cd(OH)2
|
Pt(OH)4
|
KOH
|
OH-1
|
Fe(OH)3
|
Cu+2
|
Pt(OH)2
|
Cr(OH)3
| ||||||||
A. Son ejemplos de la función ____________________ los compuestos de las casillas 10 y 7, los cuales se denominan respectivamente _______________________________________________________ y _______________________________________________________
B. Los compuestos de las casillas 1 y 9, se denominan respectivamente ___________________________________________ y ___________________________________________
C. El compuesto de la casilla 13, denominado _____________________________________________ , se forma a partir de la reacción de los compuestos de las casillas ______ y ______ , denominados ______________________ y ______________________ , respectivamente.
D. El hidróxido cromoso se encuentra en la casilla ______ , mientras que el hidróxido de potasio se encuentra en la casilla ______.
E. La fórmula del hidróxido de cobre (II) se obtiene al combinar los contenidos de las casillas ______ y ______ , respectivamente.
F. El dihidróxido de platino, ubicado en la casilla ______ , se obtiene cuando reaccionan los compuestos de las casillas ______ y ______ , denominados ______________________ y ______________________ , respectivamente.
Código 5:
II. ESCRIBE EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTO O INCORRECTO EL NOMBRE ASIGNADO AL COMPUESTO DADO. EN CASO DE SER INCORRECTO, ESCRIBE EN EL RESPECTIVO ESPACIO EL NOMBRE CORRECTO
A. AgOH monohidróxido de plata ( ) ___________________________________
B. LiOH Monohidróxido de monolitio ( ) ___________________________________
C. Al(OH)3 Hidróxido aluminoso ( ) ___________________________________
D. Au(OH)3 Hidróxido auroso ( ) ___________________________________
E. Hg(OH)2 Hidróxido mercurioso ( ) ___________________________________
F. Os(OH)8 Hidróxido de osmio ( ) ___________________________________
G. Pb(OH)2 Hidróxido de plomo (II) ( ) ___________________________________
H. Cu(OH)2 Hidróxido de cobre ( ) ___________________________________
Código 6:
III. ESCRIBE EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTA O INCORRECTA LA FORMULA ASIGNADA AL NOMBRE DADO. EN CASO DE SER INCORRECTA, ESCRIBE EN EL RESPECTIVO ESPACIO LA FORMULA CORRECTA
A. Hidróxido de plata Ag(OH)2 ( ) ___________________________________
B. Hidróxido paládico Pd(OH)2 ( ) ___________________________________
C. Tetrahidróxido de estaño S(OH)4 ( ) ___________________________________
D. Hidróxido plumboso Pb(OH)2 ( ) ___________________________________
E. Hidróxido de níquel (III) Ni(OH)3 ( ) ___________________________________
F. Hidróxido de osmio (IV) Os4OH ( ) ___________________________________
G. Hidróxido de indio I(OH)3 ( ) ___________________________________
H. Hidróxido cobaltoso Co(OH)3 ( ) ___________________________________
Código 7:
IV. COMPLETA EL SIGUIENTE CUADRO
Fórmula
|
N. Sistemático
|
N. Stock
|
N. Tradicional
|
Sn(OH)2
| |||
Dihidróxido de hierro
| |||
Hidróxido de talio (I)
| |||
Hidróxido cuproso
| |||
NaOH
| |||
Dihidróxido de níquel
| |||
Hidróxido de mercurio (II)
| |||
Hidróxido ferrico
|
Código 8:
Formular y nombrar empleando las tres nomenclaturas a:
+4
Pb
+3
Cr
+5
Bi
+8
Os
+7
Mn
Código 9:
Formular y nombrar empleando las tres nomenclaturas a:
+3
V
+1
Cu
+1
Ag
+1
Na
+2
Mg
16-08-17
Actividades de clase:
Continuar explicando la nomenclatura tradicional para óxidos.
Resolver la actividad propuesta para la semana pasada. Espero que este escrita en el cuaderno.
Práctica de laboratorio: Trabajarán de acuerdo a los grupos de tres estudiantes.
Formación de óxidos
Favor llevar gafas y tapa bocas
Copiar en el cuaderno:
Llevar los siguientes materiales:
Mechero de alcohol
Alcohol
Mechas para el mechero
1 hoja de papel aluminio
1 sobre pequeño de azufre
Óxidos metálicos
- Primero debemos de encender el mechero de alcohol
- Después sostener con las pinzas el pedazo de magnesio obtendremos la formación del óxido de magnesio..
- Después con sostener con las pinzas el pedazo de aluminio y calentarlo por un rato,en este paso se formará el óxido de aluminio.
- Calentar el hierro en la cucharilla, retirarlo del fuego hasta que el hierro se torne a un color rojizo, es entonces cuando obtendremos el óxido de hierro.
- Calentar el zinc en la cucharilla hasta que este tome un color amarillento.
- Emplear el sodio para la obtención del óxido.
- Escribir las respectivas reacciones
- Tomar las tiras de papel tornasol y efectuar el reconocimiento con el indicador suministrado por la docente.
Óxido no metálico
- Ponemos el azufre en la cucharilla y lo calentamos por un rato hasta que se caliente bien. Y así tendremos formado el oxido de azufre.
- Escribir las respectivas reacciones
- Tomar las tiras de papel tornasol y efectuar el reconocimiento con el indicador suministrado por la docente.
NOTA:
El próximo 23 de agosto se revisará el cuaderno de ortografía solicitado en clase, con las palabras resaltadas por estar mal escritas. Recordar que cada término debe ser consultado su significado y escribir cinco oraciones con cada término.
09-08-17
Actividad Extraclase:
RESOLVER EN EL CUADERNO: NO SE ACEPTA IMPRESO
1. ¿Cómo se forma un Óxido?
2. Escriba la ecuación de formación de un óxido.
3. ¿Qué es un óxido básico?
4. Escriba la fórmula de 5 óxidos básicos.
5. ¿Qué es un óxido ácido?
6. Escriba la fórmula de 5 óxidos ácidos.
Clasifique como ácidos o básicos los siguientes óxidos: Nombrarlos, según lo explicado en clase (nomenclatura sistemática)
a. CuO
b. Cl2O3
c. AuO
d. PbO2
e. HgO
f. N2O5
Elabore los siguientes compuestos::
a. Oxido ferroso
b. Oxido de aluminio
c. Trióxido de azufre
d. Oxido estánico
Actividades de clase:
Continuar explicando la nomenclatura Stock y tradicional.
Ingresar a los siguientes link y participar de las divertidas e interesantes actividades allí propuestas:
I. CON BASE EN LA INFORMACIÓN CONTENIDA EN LA REJILLA, COMPLETA LOS ENUNCIADOS PROPUESTOS
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
| ||||||||
ZnO
|
Sn+4
|
MgO
|
Hg2O
|
O-2
|
H2O
|
OsO4
|
O2
| ||||||||
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
| ||||||||
SnO2
|
Cl2O7
|
ZnO
|
OH-1
|
In
|
Fe2O3
|
In2O3
|
Sn+2
| ||||||||
A. Son ejemplos de la función ____________________ los compuestos de las casillas 14 y 4, los cuales se denominan respectivamente _______________________________________________________ y _______________________________________________________
B. Los compuestos de las casillas 3 y 15, se denominan respectivamente ___________________________________________ y ___________________________________________
C. El compuesto de la casilla 15, denominado _____________________________________________ , se forma a partir de la reacción de los elementos de las casillas ______ y ______ , denominados ______________________ y ______________________ , respectivamente.
D. El compuesto de la casilla ______ , denominado ________________________________________ , se clasifica como un óxido ácido; mientras que el de la casilla ______ , denominado _____________________________________________ , se clasifica como un óxido básico.
E. Si se combinan los iones de las casillas 2 y 5 se obtiene el compuesto de la casilla ______ , denominado _____________________________________________
F. El compuesto de la casilla 10, se denomina _____________________________________________, mientras que el de la casilla 7, se denomina _____________________________________________.
ESCRIBE EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTO O INCORRECTO EL NOMBRE ASIGNADO AL COMPUESTO DADO. EN CASO DE SER INCORRECTO, ESCRIBE EN EL RESPECTIVO ESPACIO EL NOMBRE CORRECTO
A. Y203 Dióxido de triitrio ( ) ___________________________________
B. Au2O Óxido áurico ( ) ___________________________________
C. Br2O3 Óxido bromoso ( ) ___________________________________
D. BaO Hidróxido de bario (II) ( ) ___________________________________
E. MnO3 Óxido de manganeso (III) ( ) ___________________________________
F. CrO3 Óxido de cromo ( ) ___________________________________
G. Li2O Dióxido de litio ( ) ___________________________________
H. HgO Óxido de mercúrico ( ) ___________________________________
III. ESCRIBE EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTA O INCORRECTA LA FORMULA ASIGNADA AL NOMBRE DADO. EN CASO DE SER INCORRECTA, ESCRIBE EN EL RESPECTIVO ESPACIO LA FORMULA CORRECTA
A. Óxido de rubidio Rb2O ( ) ___________________________________
B. Óxido circónico ZrO2 ( ) ___________________________________
C. Pentóxido de dinitrógeno N5O2 ( ) ___________________________________
D. Óxido plúmbico Pb4O ( ) ___________________________________
E. Óxido de azufre (IV) SO3 ( ) ___________________________________
F. Óxido de platino (IV) PtO4 ( ) ___________________________________
G. Óxido brómico B2O3 ( ) ___________________________________
H. Óxido de plata AgO2 ( ) ___________________________________
IV. COMPLETA EL SIGUIENTE CUADRO
Fórmula
|
N. Sistemático
|
N. Stock
|
N. Tradicional
|
I2O5
| |||
Dióxido de silicio
| |||
Óxido de manganeso (VII)
| |||
Óxido plumboso
| |||
SnO
| |||
Trióxido de diníquel
| |||
Óxido de platino (II)
| |||
Óxido cúprico
|
I. ESCRIBE EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTO O INCORRECTO EL NOMBRE ASIGNADO AL COMPUESTO DADO. EN CASO DE SER INCORRECTO, ESCRIBE EN EL RESPECTIVO ESPACIO EL NOMBRE CORRECTO
A. OsO4 Óxido de osmio (IV) ( ) ___________________________________
B. SeO3 Óxido de selenio ( ) ___________________________________
C. I2O5 Óxido yódico ( ) ___________________________________
D. HgO Óxido de mercurio ( ) ___________________________________
E. Li2O Dióxido de litio ( ) ___________________________________
II. ESCRIBE EN EL PARENTESIS “C” O “I”, SEGUN SEA CORRECTA O INCORRECTA LA FORMULA ASIGNADA AL NOMBRE DADO. EN CASO DE SER INCORRECTA, ESCRIBE EN EL RESPECTIVO ESPACIO LA FORMULA CORRECTA
A. Óxido de plata AgO2 ( ) ___________________________________
B. Óxido circónico ZrO2 ( ) ___________________________________
C. Óxido de nitrógeno (I) NO2 ( ) ___________________________________
D. Pentóxido de difósforo P5O2 ( ) ___________________________________
E. Óxido perclórico Cl2O5 ( ) ___________________________________
III. COMPLETA EL SIGUIENTE CUADRO
Fórmula
|
N. Sistemático
|
N. Stock
|
N. Tradicional
|
SnO
| |||
Monóxido de bario
| |||
Óxido de carbono (II)
| |||
Óxido antimónico
|
IV. RESPONDE EL SIGUIENTE CUESTIONARIO SOBRE NOMENCLATURA DE ÓXIDOS
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO I)
1. El nombre tradicional para el compuesto Ga2O3 es:
A. Trióxido de digalio
B. Óxido gálico
C. Óxido de galio
D. Óxido de galio (I)
2. La fórmula para el óxido yodoso es:
A. I2O3 C. Y2O7
B. Y2O5 D. I2O5
3. El compuesto de fórmula Co2O3 tiene como nombre tradicional:
A. Óxido de cobalto
B. Óxido cobaltoso
C. Óxido cobaltico
D. No tiene nomenclatura tradicional
4. La fórmula del óxido de nitrógeno (IV), es:
A. Ni2O3 C. NiO2
B. NO2 D. N2O4
5. El nombre stock para el compuesto CrO3 , es:
A. Óxido de cromo
B. Óxido de cromo (VI)
C. Óxido crómico (III)
D. Óxido de cromo (III)
6. La fórmula para el óxido de potasio, es:
A. P2O C. PoO
B. CaO D. K2O
2-08-17
Se realizarán las actividades pendientes por realizar, publicadas desde la semana pasada.
HOLA CHICOSS
YA SE ABRIÓ LA CONVOCATORIA PARA REGISTRASE Y PRESENTAR LAS PRUEBAS SUPERATE 2.0, DESEO QUE SE INSCRIBAN Y LA PRESENTEN EN LA FECHA INDICADA. ANIMO.
26-07-17
Felicitaciones chicos y chicas por esas clases tan divertidas y de mucho aprendizaje.
Actividades extraclase: Para resolver en casa
Terminar de consultar los datos solicitados en la tabla que se inició diligenciando en la clase de la semana pasada.
Actividades de Clase:
Continuaremos con la explicación sobre nomenclatura sistemática y stock para los óxidos. No olvidar la tabla periódica.
19-07-17
Actividades extraclase: Para resolver en casa
Realiza la fórmula para los óxidos de los elementos pares del 32 al 56. Clasificalos como óxidos básicos (si esta unido un metal) u óxidos ácidos (si esta unido un no metal). Organiza fichas con los símbolos de los primeros 30 elementos de la tabla periódica, toma como base el tamaño de una ficha de lotería.
Dibuja en foami y recorta números individuales del 1 al 7.
Actividades de clase:
Recuerda estudiar para el quiz.
Organizaremos fórmulas de óxidos con las fichas elaboradas en casa. Animo a jugar
Se explicará la nomenclatura Sistemática, stock y tradicional.
12-07-17
SE ACABARON LAS VACACIONES................DE NUEVO A ESTUDIARRRRRRRR
LOS ESPERO CON TODA LAS GANAS Y EL ENTUSIASMO POR CONTINUAR APRENDIENDO MAS SOBRE LA QUÍMICA
LOS ESPERO CON TODA LAS GANAS Y EL ENTUSIASMO POR CONTINUAR APRENDIENDO MAS SOBRE LA QUÍMICA
Hola queridos estudiantes:
A continuación relaciono las competencias del tercer período, por favor copiarlas en el cuaderno o imprimirlas y pegarlas en el cuaderno.
GIMNASIO PEDAGÓGICO NOVA ESTRELLA
III Periodo
Química
Grado Séptimo
Desempeños:
Clasifica los compuestos inorgánicos, reconociendo grupos funcionales y los nombra aplicando las reglas de la IUPAC.
Reconoce por sus propiedades a las funciones de la química mineral y los obtiene en el laboratorio.
Fomenta el interés y el desarrollo de actitudes científicas hacia la investigación.
Asumo los valores de: responsabilidad, equidad, tolerancia y respeto dentro y fuera del aula.
Conocimientos:
Formulación y nomenclatura de:
Óxidos
Hidróxidos
Ácidos
Sales
Óxidos
Hidróxidos
Ácidos
Sales
Orientador
Lic. Astrid Cardoso Contreras
Para que nuestros estudiantes, brillen por la inteligencia de su mente y de su corazón
Actividades de clase:
1° Socialización del desempeño alcanzado en el segundo período.
2° Presentación de las competencias y contenidos del tercer período.
3° Realización de la actividad de inducción al tema:
Lleva empaques de los siguientes materiales de uso diario, pegalos en el cuaderno y en clase se completará la siguiente información:
Sustancias
|
Clasificación
|
Composición
|
|
Fórmula
|
Nombre
|
||
Crema dental
|
|||
Sal de cocina
|
|||
Jabón
|
|||
Talco
|
|||
Yeso
|
|||
Lápiz labial
|
|||
Perfume
|
|||
Vinagre
|
|||
Gaseosa
|
|||
Aspirina
|
|||
Enjuague bucal
|
|||
Sal de frutas
|
|||
Decol
|
|||
4° Explicación de las diferentes funciones de la química mineral.

15-06-17
ACTIVIDAD DE CLASE:
Sin ninguna excusa se evaluarán los símbolos y nombres de los elementos de la tabla periódica, programada haceeeee ratooooo.
Evaluación ICFES de competencia. Favor estudiar.
No hay actividades extraclase.
NOTA:
Los estudiantes conocerán el mismo miércoles su nota final, por lo que quienes queden con desempeño bajo se publicará la siguiente semana su respectiva actividad de nivelación que debe ser entregada y sustentada el primer miércoles de ingreso al colegio (luego de las vacaciones).
07-06-17
ACTIVIDAD DE CLASE:
Revisión y calificación de la actividad extraclase pendiente por entregar la semana pasada.
Evaluación ICFES de competencia.
Evaluación de símbolos y nombres de los elementos de los grupos: IA, IIA, IIA, IVA, VA, VIA, VIIA, VIIIA.
ACTIVIDAD EXTRACLASE:
Ingresar a la página registrada a inicio de año:
https://miltonochoa.com.co/home/index.php y resuelve una prueba, luego imprime tu resultado y pegalo al cuaderno. Relaciono pantallazos para tener en cuenta al ingresar a la página:
Evaluación de la dimensión formativa. Favor imprimir o copiar en el cuaderno el siguiente formato y traerlo diligenciado para la clase.
Criterio
|
Autoevaluación
|
Coevaluación
|
Heteroevaluación
| |
1
|
Cumplo con la presentación oportuna de tareas y trabajos.
| |||
2
|
Presento buena disposición en clase, soy atento y participativo.
| |||
3
|
Mantengo buena disciplina durante la clase.
| |||
4
|
Acato los normas de presentación personal establecidas por la Institución.
| |||
5
|
Soy ordenado y aseado con mi entorno.
|
Total:
31-05-17
Se realizarán las actividades programadas para la semana pasada.
Favor ingresar al siguiente link:
Mide tus conocimientos y resuelve con honestidad las siguientes preguntas:
15,16,17,18,27,28,29,31,38 Y 45.
No es necesario imprimir las preguntas, solo anota en el cuaderno el tiempo empleado y el número de preguntas acertadas.
En el colegio deberás sustentar en forma escrita una de estas preguntas seleccionada al azar. Así que prepárate bien desde casa. Animó, Te invito a que te la juegues por el SABER.
En el colegio deberás sustentar en forma escrita una de estas preguntas seleccionada al azar. Así que prepárate bien desde casa. Animó, Te invito a que te la juegues por el SABER.
24-05-17
Hola queridos estudiantes:
Evaluación de símbolos y nombres de los elementos de los grupos:
IA, IIA, IIA, IVA, VA, VIA, VIIA, VIIIA.
Revisión, socialización y calificación de la actividad extraclase.
Evaluación final de competencia. Favor estudiar. No hay exoneraciones, solo a los estudiantes que se han premiado se les dará un buen y merecido porcentaje para la evaluación.
Actividad Extraclase:
Teniendo en cuenta la siguiente explicación, representa la unión en las siguientes parejas de elementos, indicando el tipo de enlace:
b) C – N
c) F – C
d) C – H
e) N – O
f) C – S
g) S – O
h) Cl – O
i) Calcio y cloro.
j) Sodio y bromo.
k) Aluminio y azufre.
l) Hidrógeno e iodo.
m) Oxígeno y oxígeno.
n) Oxígeno y flúor.
j) Sodio y bromo.
k) Aluminio y azufre.
l) Hidrógeno e iodo.
m) Oxígeno y oxígeno.
n) Oxígeno y flúor.
17-05-17
Hola queridos estudiantes:
Continuar resolviendo el taller publicado desde el 26-04.
No olvidar: Favor repasar los elementos por grupos de la tabla periódica, así:
IA, IIA, IIA, IVA, VA, VIA, VIIA, VIIIA.
Práctica de laboratorio:
Favor llevar el aparato de conductividad eléctrica (tener en cuenta el elaborado por María José Arteaga)
Llevar los siguientes materiales:
Alambre de hierro
Lámina de Aluminio
Lámina de Cobre
Lamina de cinc
Trozo de palo
Trozo de ladrillo o baldosa
Plástico
Vidrio
Carbón
Práctica de laboratorio:
Favor llevar el aparato de conductividad eléctrica (tener en cuenta el elaborado por María José Arteaga)
Llevar los siguientes materiales:
Alambre de hierro
Lámina de Aluminio
Lámina de Cobre
Lamina de cinc
Trozo de palo
Trozo de ladrillo o baldosa
Plástico
Vidrio
Carbón
10-05-17
Hola queridos estudiantes:
No se programan actividades, ya que muy posiblemente no habrá clase por el Santo Rosario del Colegio.
03-05-17
Hola queridos estudiantes:
Se programan las mismas actividades para la presente clase.
26-04-17
Hola queridos estudiantes:
ACTIVIDADES DE CLASE:
Consulta el valor de electronegatividad, apoyado en la anterior imagen y dado los siguientes compuestos, agrupar de acuerdo a si tienen enlace covalentes simples, dobles o triples.
Consulta el valor de electronegatividad, apoyado en la anterior imagen y dado los siguientes compuestos, agrupar de acuerdo a si tienen enlace covalentes simples, dobles o triples.
1. H2 2. Cl2 3. O2 4. N2 5. F2
6. CO2 7. H2O 8. HNO2 9. HCl 10. CO
5° Elabora la fórmula estructural a las anteriores moléculas
6° Indicar si los siguientes enlaces son moléculas polar o apolar y dibuje la molécula, teniendo en cuenta la siguiente imagen:
NOTA: El átomo mas electronegativo, en este caso el cloro, adquiere la carga parcial negativa, y el menos electronegativo, en este caso. el hidrogeno la carga parcial positiva.

1. H2 →
2. Cl2 →
3. O2 →
4. N2 →
5. F2 →
6. CO2 →
7. H2O →
8. HNO2 →
9. HCl →
10. CO →
Teniendo en cuenta la siguiente explicación, representa la unión en las siguientes parejas de elementos, indicando el tipo de enlace:
b) C – N
c) F – C
d) C – H
e) N – O
f) C – S
g) S – O
h) Cl – O
i) Calcio y cloro.
j) Sodio y bromo.
k) Aluminio y azufre.
l) Hidrógeno e iodo.
m) Oxígeno y oxígeno.
n) Oxígeno y flúor.
j) Sodio y bromo.
k) Aluminio y azufre.
l) Hidrógeno e iodo.
m) Oxígeno y oxígeno.
n) Oxígeno y flúor.
Quiz de los grupos de la tabla periódica:
IA, IIA, IIA, IVA, VA, VIA, VIIA, VIIIA.
ACTIVIDAD OPTATIVA
19-04-17
Hola queridos estudiantes:
A continuación relaciono las competencias del segundo período, por favor copiarlas en el cuaderno o imprimirlas y pegarlas en el cuaderno.
GIMNASIO PEDAGÓGICO NOVA ESTRELLA
II Periodo
Química
Grado Séptimo
Competencias:
Usa modelos y representaciones (Bohr, Lewis) que le permiten reconocer la estructura del átomo y su relación con su ubicación en la Tabla Periódica.
Comprueba el comportamiento químico fundamentado en el enlace químico de sus moléculas.
Explica cómo las sustancias se forman a partir de la interacción de los elementos y que estos se encuentran agrupados en un sistema periódico.
Ubica a los elementos en la Tabla Periódica con relación a los números atómicos (Z) y másicos (A).
Asumo los valores de: responsabilidad, equidad, tolerancia y respeto dentro y fuera del aula.
Conocimientos:
Enlace iónico y covalente
Estereoquímica
Polaridad de los enlaces
Enlaces intermoleculares y su relación con las propiedades físicas de los compuestos
Determinación de formulas químicas
Formula empírica y molecular
La Tabla Periódica: Grupos y períodos
Orientador
Lic. Astrid Cardoso Contreras
Para que nuestros estudiantes, brillen por la inteligencia de su mente y de su corazón
ACTIVIDADES DE CLASE
1° Socialización del desempeño alcanzado en el primer período.
2° Presentación de las competencias y contenidos del segundo período.
3° Imprime y observa la siguiente imagen. Selecciona 10 elementos de la tabla periódica y consulta la información allí solicitada:
1. H2 2. Cl2 3. O2 4. N2 5. F2
6. CO2 7. H2O 8. HNO2 9. HCl 10. CO
5° Elabora la fórmula estructural a las anteriores moléculas
6° Indicar si los siguientes enlaces son moléculas polar o apolar y dibuje la molécula, teniendo en cuenta la siguiente imagen:
NOTA: El átomo mas electronegativo, en este caso el cloro, adquiere la carga parcial negativa, y el menos electronegativo, en este caso. el hidrogeno la carga parcial positiva.

1. H2 →
2. Cl2 →
3. O2 →
4. N2 →
5. F2 →
6. CO2 →
7. H2O →
8. HNO2 →
9. HCl →
10. CO →
Teniendo en cuenta la siguiente explicación, representa la unión en las siguientes parejas de elementos, indicando el tipo de enlace:
b) C – N
c) F – C
d) C – H
e) N – O
f) C – S
g) S – O
h) Cl – O
i) Calcio y cloro.
j) Sodio y bromo.
k) Aluminio y azufre.
l) Hidrógeno e iodo.
m) Oxígeno y oxígeno.
n) Oxígeno y flúor.
j) Sodio y bromo.
k) Aluminio y azufre.
l) Hidrógeno e iodo.
m) Oxígeno y oxígeno.
n) Oxígeno y flúor.
ACTIVIDAD EXTRACLASE: Para el 26 de abril
Favor repasar los elementos por grupos de la tabla periódica, así:
IA, IIA, IIA, IVA, VA, VIA, VIIA, VIIIA.
ACTIVIDAD OPTATIVA:
El próximo 22 de abril se celebra el día mundial de la Tierra y es mi deseo como ser vivo involucrarlos a ustedes que también son seres vivos en sencillas actividades que les recuerden ese compromiso con la madre tierra
El Día Internacional de la Madre Tierra (Earth Day) se celebra el 22 de Abril de 2017. En esta fecha se intenta concienciar al mundo de la necesidad de proteger el medio ambiente y de la conservación de la biodiversidad. Así como paliar la superpoblación, la contaminación y hacer un uso responsable de los recursos naturales. Para ello todos los años las Naciones Unidas saca un lema y en numerosos países se realizan actividades de concienciación como conferencias, plantación de árboles, caminatas y actividades relacionadas con la ecología.
El Lema para el día de la Tierra en el año 2017 es el siguiente:
«Alfabetización Ambiental y Climática» (Environmental and Climate Literacy)
Nuestro planeta tierra en cifras:
- Surgió hace más de 4.500 millones de años aproximadamente, junto con los demás planetas del sistema solar
- Mide 12.713 km. de diámetro de polo a polo y 12.756 por el Ecuador. Por ello tiene forma esférica, ligeramente achatada en los polos y ensanchada en el Ecuador
- La superficie terrestre es de 510 millones de Km 2 aproximadamente.
- El volúmen total de agua de la tierra se estima en 1.420 millones de kilómetros cúbicos, incluyendo la contenida en ríos, lagos, hielo, océanos, atmósfera y el subsuelo.
- El volumen total de la tierra es de 1.083 mil 320 millones de kilómetros cúbicos.
- El punto más alto de la tierra es el Monte Everest con 8.848 m. La mayor depresión es el Mar Muerto, un mar interior cuya superficie está a 399 m. bajo el nivel del mar.
- Posee más de 6.000 millones de personas, la mitad de los cuales tiene menos de 25 años.
- Da un giro completo alrededor del sol en 365 días, 6 horas, 9 minutos y 9 segundos (aproximadamente un año)
- Gira sobre si misma en 23 horas, 56 minutos y 4 segundos (aproximadamente un día)
- Su velocidad promedio en el universo es de 30 km. por segundo.
Algunos de sus principales males:
- Reducción de la Capa de Ozono, causado por contaminantes que son arrojados en la atmósfera, particularmente gases refrigerantes, CFCs
- Lluvia Acida, causada por el dióxido de azufre de las industrias, afectando la composición del suelo y las aguas, afectando la vida sobre el planeta.
- Basura, acumulándose en todos los espacios del planeta
- Contaminación sónica, afectando a millones de personas, causando hipertensión arterial, ulceras, sordera, gastritis y hasta impotencia sexual.
- Contaminación de los suelos, por toneladas de plaguicidas, residuos tóxicos y desechos petroleros y mineros.
- Contaminación atmosférica, millones de vehículos aportan día a día toneladas de gases que deterioran la calidad del aire y lo hacen menos respirable
- Explosión demográfica. Cada día nacen alrededor de 250 mil niños en el mundo y cada año la población aumenta en 80 millones de seres humanos.
- Deforestación. Cerca de 170 mil km 2 de bosques desaparecen anualmente.
- Extinción de Especies. Alrededor del 15% de las aves y del 25% de los mamíferos del planeta se encuentran amenazados
- Tráfico de Especies, convertido en el tercer negocio más lucrativo del mundo, ha acabado con miles de especies animales y vegetales.
- Contaminación de las aguas, por un manejo inadecuado de los desechos, aguas servidas, plaguicidas y fertilizantes.
- Desertificación, buena parte del planeta comienza a transformarse en desiertos, con el subsiguiente agotamiento de los recursos que inci de en las probabilidades de obtener alimentos nutritivos.
Como puedes participar?:
Con todas o cualquiera de las siguientes actividades
Reciclatón: Campaña a realizar en la casa o en colegio durante el descanso.
Elementos a reciclar: Papel y botellas
Implementos: Bolsa verde para reciclar el papel y negra para las botellas
Llevar las bolsas con lo reciclado al colegio en la hora de clase para ser vendido y con el dinero comprar una planta y su matera para donarla al colegio.
Pinta Verde: Diseña el logo original para la celebración del día de la tierra 2017, enfatizando el tema o problemática central, antes expuesta. Puedes elaborarlo en el material que desees. Animo.
12-04-17
Hola queridos estudiantes.
Mil disculpas por no haber contestado a sus preguntas.
Esa nota de prueba virtual se aplaza para el segundo período, dada las dificultades presentadas.
Tranquilos y disfruten de la Semana Santa.
05-04-17
Hola queridos estudiantes:
Actividad extraclase:
Ingresar a la página de https://miltonochoa.com.co/home/index.php y resolver uno de los cuestionarios propuestos para el grado séptimo, sin importar los temas que evalúen, luego toma pantallazo a los resultados logrados sin importar la calificación obtenida. Imprime y pega en el cuaderno el resultado. Lo importante es que practiques en casa este tipo de pruebas. Recuerda que desde febrero se solicito la inscripción a esta página.
Ver de nuevo el vídeo publicado la semana pasada y organiza en el cuaderno un completo mapa conceptual del tema allí expuesto.
Qué tipo de enlace se formará entre las siguientes parejas de elementos:
P y O
N y Ba
Oy Te
F y O
K-N
Br-Zn
F-Na
Mg-O
Cl-H
K-O
S-Ca
Cl-C
Cl-O
Na- H
Ca- Br
Actividades de clase:
Continuar organizando las moléculas iniciada la clase pasada. Favor traer de nuevo los materiales y además dos pliegos de cartulina y lana.
Evaluación de la dimensión formativa. Favor imprimir o copiar en el cuaderno el siguiente formato y traerlo diligenciado para la clase.
Criterio
|
Autoevaluación
|
Coevaluación
|
Heteroevaluación
| |
1
|
Cumplo con la presentación oportuna de tareas y trabajos.
| |||
2
|
Presento buena disposición en clase, soy atento y participativo.
| |||
3
|
Mantengo buena disciplina durante la clase.
| |||
4
|
Acato los normas de presentación personal establecidas por la Institución.
| |||
5
|
Soy ordenado y aseado con mi entorno.
|
Total:
Socialización de los desempeños logrados en el primer período.
Entrega de actividades de nivelación para los estudiantes con desempeño Bajo, para ser entregados y sustentados después de semana Santa.
29-03-17
Hola queridos estudiantes:
Actividad extraclase:
Realizar la distribución electrónica a los elementos representativos de la tabla periódica y completar la información solicitada a continuación:
elemento
|
z
|
d. electrónica
|
e. de valencia
|
Formula de Lewis
|
carácter
|
electronegatividad
|
Trae para clase el siguiente material:
10 bolitas de icopor de la más pequeña
6 bolas medianas
Marcador
Caja de palillos pequeños
Estos materiales los puedes traer en grupo para minimizar gastos.
22-03-17
Hoy se celebra el día mundial del agua, por lo tanto como ser humano que eres te invito de manera voluntaria que veas el siguiente vídeo: Oro azul, la guerra del agua
y realices lo siguiente:
Comentar en el blog, aspectos del vídeo que te llamaron la atención.
Realiza en casa o donde prefieras acciones que contribuyan al ahorro y uso racional del agua. Envía estas evidencias al correo: laestrellaylaluna_6@hotmail.com.
Dibuja en tu cuaderno el logo mundial establecido por la ONU para la celebración de dicha fecha y explica el mensaje que quieren transmitir.
ACTIVIDADES EXTRACLASE:
Analiza la siguiente animación y da una explicación de lo que logres entender. Qué tema de la química estudiará ese comportamiento? Cuáles son los elementos más débiles? Por qué? Cuáles son los más fuertes? Por qué?
Ahora propón un divertida historieta que explique el comportamiento químico.
Favor copiar o imprimir el siguiente mapa conceptual:
ACTIVIDAD DE CLASE:
Revisión y valoración de la actividad extraclase.
Explicar el tema de enlaces, apoyado en el siguiente vídeo:
15-03-17
ACTIVIDADES DE CLASE:
Evaluación ICFES del tema: Propiedades periódicas.
Favor estudiar.
ACTIVIDAD EXTRACLASE:
Terminar de completar las tablas iniciadas en clase con los elementos del 1 al 35.
No olviden escribir mínimo una conclusión.
08-03-17
Hola queridos estudiantes, reciban un abrazo grandoteeee:
ACTIVIDADES DE CLASE:
Continuar resolviendo la actividad propuesta en la clase anterior.
Ingresar al siguiente link para resolver las actividades allí sugeridas:
ACTIVIDAD EXTRACLASE:
Favor ver en casa el vídeo y organizar en el cuaderno las principales ideas en un mapa conceptual.
Hola queridos estudiantes:
Deseo felicitarlos por el interés y el gusto demostrado en cada actividad de clase y extraclase.
Estoy muy contentaaaaaaa de verlos así de juiciosos y mejorando día a día el valor de la responsabilidad. No cambien.
NO HAY ACTIVIDADES EXTRACLASE.
Actividades de clase:
Resolver la siguiente actividad: Favor traerla impresa en grupos de 2 estudiantes.
RADIO ATÓMICO
¿Cuál es el elemento que presenta mayor radio atómico?
Indica cuál de los órdenes de los siguientes elementos en función de sus tamaños atómicos es falso:
La serie de elementos que no está en orden creciente de sus tamaños atómicos es:
¿Cuál es la forma correcta de ordenar los siguientes elementos, de acuerdo a su tamaño atómico?
¿Por qué disminuyen los radios atómicos de izquierda a derecha en cada periodo de la tabla periódica?
¿Cuál de los siguientes átomos presenta el menor tamaño?
Ordena los átomos siguientes, Rb, Ca, As, Ir y Zr, en función de su tamaño atómico:
POTENCIAL DE IONIZACIÓN
Indica de las siguientes configuraciones que corresponden a átomos neutros (A = 1s22s22p3; B = 1s22s22p5; C = 1s22s22p23s1; D = 1s22s22p63s2)qué elemento presenta el mayor potencial de ionización.
Dadas las siguientes configuraciones que corresponden a átomos neutros (A = 1s22s2; B = 1s22s22p1; C = 1s22s22p5; D = 1s22s22p6), indica cúal de ellos posee el mayor valor del segundo potencial de ionización
¿Cuál es la forma correcta de ordenar los siguientes elementos atendiendo a su energía de ionización?
¿Cuál de los átomos siguientes es el que posee el mayor potencial de ionización?
ELECTRONEGATIVIDAD
Ordene los átomos siguientes de menor a mayor electronegatividad: Li, Ca, C y Se
¿Cuál es la tendencia general de la electronegatividad a lo largo de un período?
Ordena de mayor a menor según sus electronegatividades a los siguientes átomos: N, P, Al y Na
¿Qué es la electronegatividad?
Indique cuál es elemento más electronegativo de la serie: Be, Ba, Ca y Mg
ELECTROAFINIDAD
Indica de las seguintes configuraciones que correspondem a átomos neutros (A = 1s22s22p3; B = 1s22s22p5; C = 1s22s2p6; D = 1s22s22p63s1) que elemento presenta la mayor electroafinidad.
¿Cuál es la tendencia general de las afinidades electrónicas a lo largo de un período?
¿Cuál es la definición de afinidad electrónica?
¿Cuál de las siguientes especies, S, As, K y Cl presenta el valor más alto de electroafinidad?
Ordene los átomos siguientes de menor a mayor afinidad electrónica: Li, K, C y N
¿Qué grupo de elementos tiende a presentar altas afinidades electrónicas?
¿Cuál de los siguientes elementos: Cs, P, Cl y Ca, presenta la mayor electroafinidad?
Cuatro elementos diferentes A, B, C y D tienen de número atómico 6, 9, 13 y 19 respectivamente. ¿Cúal es el elemento que presenta la mayor electroafinidad?
¿Cuál de los metales siguientes, Cd, Ca, Cu y Cr, presenta la electroafinidad más negativa?
Hola queridos estudiantes:
Actividades de clase:
1° Continuar resolviendo las actividades relacionadas con:
Energía de Ionización
Afinidad Electrónica
2° Proyección del vídeo para explicar el tema de propiedades periódicas:
Actividades extraclase (para ser resueltas en casa):
Dibuja dos tablas periódicas y en cada una de ella completa solo la siguiente información:
Símbolo, Z, valor de electronegatividad
Símbolo, Z, valor de tamaño atómico
Febrero 15 de 2017
Hola queridos estudiantes:
Actividades de clase:
Continuar resolviendo las actividades empezadas en la clase pasada.
Estudiar los 40 primeros elementos, para participar de las actividades programadas.
Aún no se publica la guía.
Febrero 8 de 2017
Hola queridos estudiantes espero hayan descansado lo necesario y vengan con todas las energías puestas, ya que les esperan muchísimos conocimientos para enriquecer el SABER.
ACTIVIDADES DE CLASE:
1°Presentación y explicación de pautas de la clase y criterios de evaluación del área.
2°Organización de la lista de clase.
3° Entrega de temas y competencias del período
GIMNASIO PEDAGÓGICO NOVA ESTRELLA
I Periodo
Del 1 de Febrero al 07 de Abril
QUÍMICA
Grado Séptimo
Saber:
Comprender el comportamiento químico de los
elementos de acuerdo a sus propiedades periódicas.
Hacer:
Demostrar habilidades en el desarrollo de prácticas
experimentales.
Ser:
Cumplir con los deberes del área.
Temas:
Propiedades Periódicas
Tamaño Atómico
Electronegatividad
Potencial de Ionización
Afinidad electrónica
Orientador
Lic. Astrid Cardoso Contreras
Unidos y motivados seguiremos adelante para ser cada día mejor en el SER, el HACER y en el SABER
6. TALLER PROPIEDADES
Completa la siguiente tabla con la información allí solicitada:
ELECTRONEGATIVIDAD
Elemento
|
Símbolo
|
z
|
Carácter
|
Valor
|
Azufre
| ||||
Hidrogeno
| ||||
Oxigeno
| ||||
Cloro
| ||||
Flúor
| ||||
Fosforo
| ||||
Potasio
| ||||
Nitrógeno
| ||||
Carbono
| ||||
Estaño
| ||||
Bromo
| ||||
Arsénico
| ||||
Litio
| ||||
Calcio
| ||||
Magnesio
| ||||
Plomo
| ||||
Iodo
|
Registra los datos anteriores en un plano cartesiano y con base en el resuelve las siguientes preguntas:
a. Cual es el elemento con mayor electronegatividad? Qué carácter presenta?
b. Cual es el elemento con menor electronegatividad? Qué carácter presenta?
c. Organice los elementos de menor a mayor electronegatividad.
d. Elabore el croquis de la tabla periódica e indique con flechas la variación de esta propiedad por periodos y grupos.
e. Que entiende por electronegatividad?
f. Escriba mínimo 3 conclusiones de lo observado n la tabla.
Repita cada paso anterior, teniendo en cuenta:
a. Tamaño atómico
b. Potencial de ionización
c. Electroafinidad.

























hola profe soy Andres felipe nuñez :) es que tenia mucha vomito y mareo y estaba con mucho dolor de estomago,por eso no estuve en sus clases estoy adelantado con tareas, por eso le quiero decir que el miércoles voy con muchas ganas :) de de todas maneras esto esta en el cuaderno gracias profe por su comprensión esta luego.
ResponderEliminarppd: Andres felipe nuñez tovar
LISTO.
Eliminar:)
Eliminarprofe las actividades extra clase son las que usted deja para la casa?
ResponderEliminarpor cierto yo soy Arley Felpe Devia
hola profe con cada tabla solo una conclucion o por los 35 una conclucion
ResponderEliminarsoy brian
ResponderEliminarCon cada tabla solo una conclusión.
ResponderEliminarhola profe buen día:
ResponderEliminares para decirle sobre el comentario del vídeo me pareció muy bonito por que vamos a poder saber mas sobre el agua y como se hizo,y lo que mas me intereso fue que ya vamos a prender a cuidar el agua por que es única y la tenemos que cuidar.
Gracias por tu comentario.
Eliminarprofe a mi me gusto el vídeo por que nos enseña a cuidar el agua por que hoy en día esta pasando muchas cosas malas en nuestro planeta lo peor es el hes cases de agua que esta haciendo sufrir a muchas personas lo que me reflejo el viseo es que si ahorramos cada gota de agua no sufriremos mas
ResponderEliminarprofe buenas tardes:me gusto el vídeo porque nos hace reflexionar de que no malgastemos ni desperdiciemos el agua, ya que muchas empresas están intentando adueñarse de ella, así que si no la cuidamos terminaremos sin agua y las grandes empresas se quedaran con el agua de la comunidad y de todo el mundo aunque generalmente si se acaba el agua todos nos morimos porque el agua nos da vida. Ok profe esto fue todo espero que le guste me encanto el vídeo y comparto el mensaje de mi compañero Nicolas:
ResponderEliminarGota a gota, el agua se agota.
Una gota puede hacer la diferencia.
y esa diferencia eres tu.
Gracias por tu comentario.
Eliminarajajjajajajajaj profe comparto el mensaje de Nicolas por que me gusta no por que me quiera copiar
ResponderEliminarprofe que pena esto el logo del agua es el de esas dos llaves que ud dejo arriba que una esta regando agua y otra barro
ResponderEliminarHola Profe, me listo mucho la atención este video ya que aquí muestran como se estamos desperdiciando el agua, nosotros en unos años pagaremos las consecuencias de nuestros actos fatales contra y estros ecosistemas. Aun estamos a tiempo de reparar lo que dañamos, no nos rindamos, que unidos como un. Mundo y sin rivalidades lo lograremos, en este video se muestra todo aquello que hemos causado, el hombre no piensa las consecuencias de sus actos. Recordar que el agua es nuestro líquido vital, es triste ver como una humanidad llena de tecnología, no pueda ver lo mas importante y es nuestro alrededor, pensemos y analicemos, propagemos este mensaje!!!. También es importante recordar que no solo le estamos haciendo daño a el agua si no que también a la fauna, la flora que hoy en día aún tenemos, mi mensaje o reflexión es para evaluarnos y si lo hicimos alguna vez no volverlo a repetir, tenemos a nivel mundial solo el 3% de agua dulce, nuestra agua potable, analicemos, todos unidos podemos!!!
ResponderEliminarTu eres una líder, aprovecha esta virtud y anima a las demás personas a ahorrar el agua.
EliminarGracias por tu comentario.
el vídeo nos cuenta la importancia que es el agua en el mundo por eso hay que cuidarla y no malgastarla por que nos podemos extinguir no solo los humanos todos los seres vivos que abitan en nuestro planeta que es la fauna y flora y este es un liquido vital.hay fundaciones de es tipo que ayudan para no malgastar el agua por eso es que hoy 22 de marzo es un día muy importante que es el dia del agua que VIVA!!!! ESTE DIA TAN BONITO :)
ResponderEliminarTu comentario me anima y me alegra.
EliminarGracias por tu comentario.
:) jijij
ResponderEliminarHola profe buenas tardes:
EliminarPara comentarle que no pudimos acceder al link de Miltón Ochoa y le estamos informando para que lo tenga en cuenta.
gracias profe por su atención
Interesante y agradable tu reflexión.
ResponderEliminarGracias por tu comentario.
profe no puede entral al link que tu dejaste en la tarea me puede dar una solucion
ResponderEliminarlo el video es sobre los elanses quimicos o el del agua
ResponderEliminarprofe con todo respeto le digo que no pude hacer esa tarea de la pagina por que le doy a registrarse y no me deja dice que no se encontro
ResponderEliminargracias
Pídele ayuda a un adulto.Es necesario tener cuenta en gmail. LLeva al colegio una cuenta gmail y su contraseña.
EliminarEliminar
hola profe astrid no pude ir por que tenia casos familiares y me toco viajar para ibagué pero la próxima clase sin falta
ResponderEliminarNos vemos Dios mediante en la próxima clase.
ResponderEliminarhola profe buenos dias quiero saber mis notas del periodo las puede subir por favor
ResponderEliminarprofe yo no entendi el tema de oxido acido y oxido basico
ResponderEliminarEn clase jugaremos con las fichas, entonces podrás reforzar el tema.
ResponderEliminarprofesora Astrid no podre asistir a la clase de quimica hoy porque mi mama se va a girardod a ser hacer unas deudas por eso no puedo asistir a quimica gracias
ResponderEliminarBuen Día Profe, la actividad de clase la voy a realizar en una hoja examen, luego la pego en el cuaderno debido a que usted tiene los cuadernos
ResponderEliminarListo.
ResponderEliminar